O AKKERMANSII ODBORNĚ
Informace zdravotního či medicínského charakteru uvedené na této internetové stránce se nevztahují k doplňku stravy Akkermansia od společnosti Pendulum, ale pojednávají výlučně o bakterií Akkermansia muciniphila jako takové a vycházejí ze studií a výzkumů provedených za použití bakterie Akkermansia muciniphila.
Hloubkový profil střevního komenzála Akkermansia muciniphila
Připravilo oddělení výzkumu a vývoje společnosti Pendulum Therapeutics.
Abstrakt
Akkermansia muciniphila je jedním z nejhojněji se vyskytujících druhů bakterií ve zdravém lidském střevě se schopností přizpůsobit se prostředí střevní sliznice. Jediným zdrojem uhlíku, dusíku a energie je pro A. muciniphila mucin. Likvidací mucinu pak A. muciniphila uvolňuje cukry a mastné kyseliny s krátkým řetězcem, které podporují růst dalších zdraví prospěšných střevních mikroorganismů. Díky těsnému spojení se střevní výstelkou je A. muciniphila připravena interagovat s hostitelem a modulovat tak jeho reakce. Skrze různé in vitro a in vivo modely bylo prokázáno, že podávání živých či pasterizovaných buněk A. muciniphila má významný vliv na regulaci imunitního systému a metabolismu. Stejnou schopnost mají i složky odvozené od těchto buněk jako např. membránové složky a vylučované proteiny. Imunomodulace je výsledkem snížení propustnosti střevní bariéry a obnovení mucinové vrstvy, čemuž A. muciniphila napomáhá. Bakterie má zároveň schopnost přímo ovlivňovat vrozené a adaptivní imunitní reakce. Vzhledem k tomu, že zvýšená střevní propustnost a chronický zánět jsou markery mnoha onemocnění, suplementace A muciniphila má v případě lidského zdraví pozitivní efekt na mnoho sledovaných ukazatelů. A. muciniphila se podílí na regulaci metabolismu hostitele a bylo prokázáno, že zabraňuje nárůstu hmotnosti a tukové hmoty. Zároveň zlepšuje inzulínovou rezistenci hostitele a působí proti dysregulaci glukózy a lipidů v organismu hostitele. Tyto účinky mohou být částečně zprostředkovány schopností A. muciniphila ovlivňovat endokrinní funkce hostitele a signální molekuly (např. endokanabinoidy). Společnost Pendulum nedávno potvrdila bezpečnost a účinnost podávání probiotika A. muciniphila pilotní studií u dobrovolníků s nadváhou/inzulinovou rezistencí a také druhou klinickou studií u pacientů s diabetem 2. typu, kterým byl podáván vícekmenový symbiotický přípravek obsahující A. muciniphila. Cílem tohoto přehledu je popsat mechanismy, kterými A. muciniphila působí na hostitele, a zdůraznit její jedinečný potenciál jako probiotikum nové generace.
Obsah
Akkermansia muciniphila, mucinový specialista
Trofické struktury A. muciniphila
Akkermansia muciniphila, střevní propustnost a imunitní homeostáza
Akkermansia muciniphila a metabolismus hostitele
Akkermansia muciniphila v klinických údajích použití u lidí: spojitosti a příčinné souvislosti
Zásahy ke zvýšení početnosti A. muciniphila
Akkermansia muciniphila, mucinový specialista
V lidském střevě se nacházejí biliony mikroorganismů, souhrnně označovaných jako střevní mikrobiom, které jsou nezbytné pro náš zdravý vývoj a fungování. Vzhledem k přímému vztahu těchto bilionů mikrobů s tkání hostitele však představují stálé riziko invaze komenzálů a patogenů. Aby střevní mikrobiota byla v rovnováze a byla obsažena především ve střevním lumen, vytváří střevní epitel mezi sebou a lumen fyzickou bariéru tvořenou gelovitým hlenovým obalem, který v různé tloušťce chrání celou epitelovou tkáň. Je vylučován specializovanými střevními epitelovými buňkami, označovanými jako pohárkové buňky. Hlen se skládá z molekul zvaných muciny: jedná se o membránově vázané nebo vylučované glykoproteiny, tj. bílkoviny obsahující polysacharidy (glykany). Glykoproteiny mucinů mají společnou základní strukturu složenou z lineárního bílkovinného řetězce, ze kterého ční jednotlivé rozvětvené cukry (obr. 1). Tím vzniká jejích „péřový“ vzhled umožňující na základě hydratace rychle bobtnat a vytvářet účinnou bariéru připomínající gel. Nejrozšířenějším a nejlépe prozkoumaným mucinem je MUC2 (1). Ztráta genu zodpovědného za produkci MUC2 u myší kriticky snižuje hlenovou bariéru a vede ke vzniku kolorektálního karcinomu (2). U lidí jsou alterace hlenové vrstvy spojeny s mnoha chorobami, což zdůrazňuje význam této bariéry pro homeostázu imunitního systému a celkové zdraví (3).
Kromě mucinů vylučuje střevní epitel také antimikrobiální peptidy. V kombinaci s fyzickou slizniční bariérou vzniká prostředí, ve kterém dokáže přežít jen malé množství mikrobů. Mikrobi se schopností života v těchto podmínkách však mohou mít oproti obyvatelům střevního lumen výhodu. Dochází zde totiž k neustálému vylučování mucinu, vynikajícího zdroje potravy pro mikroorganismy, které k němu mají přístup. Tato slizniční vrstva tak představuje stabilní životní prostředí. Naproti tomu střevní lumen je mnohem hustěji osídleno, což pro mikroby představuje mnohem větší konkurenci. Pro toto prostředí je zároveň typická také kolísavost mikrobům přístupných živin (zvyšuje se např. po konzumaci jídla s vysokým obsahem vlákniny) (4). Co se mucinu týče, vzhledem k jeho složité struktuře je vyžadována přítomnost zvláštní řady vylučovaných enzymů, které k němu mají přístup a jsou schopné jej rozložit. Studie ukázaly, že u hlodavců vede k relativnímu nárůstu těchto specializovaných mikrobů dieta s nízkým obsahem vlákniny (podmínky deprivace živin v lumen tlustého střeva), což potvrzuje jejich schopnost prospívat v podmínkách s nedostatkem živin (5,6). Mucin tedy umožňuje stabilní kolonizaci pouze úzké podskupině střevních mikrobů. Takoví mikrobi jsou díky své blízkosti k buňkám hostitele kdykoli připraveni interagovat. Pro zdravou střevní sliznici je přirozený stav symbiózy, kdy si hostitel vybírá správné mikroby, které si chce udržet v blízkosti, a mikrobi vázaní na mucin zase pomáhají udržovat zdravou střevní sliznici. Tento rozdíl mezi mikroby vázanými na mucin a luminálními mikroby se vyskytuje nejen u lidí, ale i u mnoha dalších živočichů, a zdůrazňuje význam vázanosti na mucin jako evoluční strategie přinášející výhody jak hostiteli, tak mikrobům.
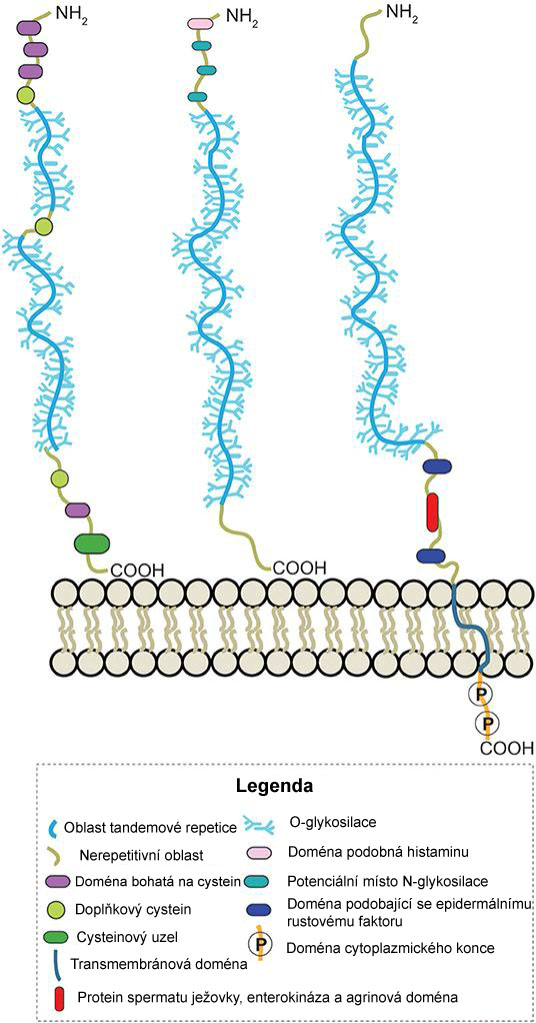
Obrázek 1: Schématické znázornění struktury vylučovaných gelotvorných, vylučovaných negelotvorných a transmembránových lidských mucinů.
Zdroj: Martin et al. Front. Chem., 22. říjen 2019
https://doi.org/10.3389/fchem.2019.00710
Jedním z hlavních mikroorganismů vázaných na mucin u člověka je Akkermansia muciniphila. A. muciniphila byla poprvé izolována ze stolice zdravého dobrovolníka v roce 2004 Derrienem et al.(7). Jedná se o jeden z nejhojnějších druhů mikroorganismů ve zdravém lidském střevě, představuje 3 až 5 % celkové fekální mikrobioty (8). Je to gramnegativní anaerob a jediná bakterie z kmene Verrucomicrobia široce zastoupená ve střevním mikrobiomu. A. muciniphila je specificky přizpůsobena slizničnímu prostředí – je schopná pro růst využívat mucin, který je pro ni jediným zdrojem uhlíku a dusíku. Velká část jejího genomu kóduje vylučované enzymy, včetně rozmanitého souboru vylučovaných enzymů rozkládajících mucin (9). Její schopnost konzumovat mucin vede k pozitivní selekci pobytu v hlenové vrstvě, ale zdá se, že A. muciniphila je schopna také přímo přilnout k epiteliálním buňkám (10), což může dále zvýšit její schopnost stabilně kolonizovat střevo. Mezi A. muciniphila a imunitními a endokrinními funkcemi hostitele existuje řada souvislostí. V následujících kapitolách je vysvětleno několik mechanismů, pomocí kterých A. muciniphila působí na hostitele. Tyto prospěšné vlivy jsou důsledkem působení metabolitů či proteinů, které A. muciniphila sama produkuje. Při rozkladu mucinu navíc uvolňuje A. muciniphila cukry a mastné kyseliny s krátkým řetězcem (SCFA), jako je např. acetát a propionát. Uvolněné cukry a acetát mohou podporovat šíření dalších potenciálně zdraví prospěšných mikrobů.
Trofické struktury A. muciniphila
Jak již bylo zmíněno, A. muciniphila je přizpůsobena životnímu stylu vázanému na mucin, který je schopna využívat jako jediný zdroj potřebných látek k růstu, uhlíku a dusíku. Při konzumaci mucinových glykanů uvolňuje A. muciniphila acetát a propionát (mastné kyseliny s krátkým řetězcem s příznivými účinky na fyziologii hostitele) a zároveň uvolňuje cukry odvozené od mucinu. Tyto látky (cukry, acetát) dále podporují cross-feeding, což znamená, že metabolické produkty vznikající růstem A. muciniphila podporují růst jiných druhů mikrobů. A. muciniphila tak funguje jako klíčová bakterie ve slizničním prostředí, protože vytváří trofické struktury – sítě mikrobů propojených vzájemnými interakcemi. Výstelka střevní sliznice je však také obsazena také mikroby, kterým chybí enzymy potřebné k rozkladu mucinu. Bakterie jako Anaerobutyricum hallii, Anaerostipes caccae a Faecalibacterium prausnitzii jsou důležitými obyvateli zdravého střeva, protože jejich růst a metabolismus vytváří butyrát, důležitý zdraví podporující mikrobiální metabolit. Laboratorní testy však prokázaly, že žádný z těchto kmenů nemá schopnost konzumovat mucin. V případě, že mucin je jedinou dostupnou živinou, nemohou růst a produkovat butyrát. Mohou však konzumovat cukry odvozené od mucinu, tj. cukry, které se uvolňují při spotřebě mucinu (11,12). Znamená to tedy, že mohou růst, pokud je přítomna A. muciniphila. A. muciniphila spotřebovává mucin, produkuje acetát a uvolňuje cukry, které butyrogenní bakterie využívají k růstu a produkci butyrátu (obr. 2). Vzhledem k tomu, že k těmto trofickým interakcím dochází ve slizniční vrstvě, je vytvořený butyrát v těsné blízkosti hostitelských buněk a je připraven uplatnit své příznivé účinky. Navíc se zdá, že A. muciniphila reaguje na přítomnost specifického producenta butyrátu, A. caccae, zvýšením své kapacity pro degradaci mucinu (tj. zvýšením regulace genů pro degradaci mucinu) (13). Interakce mezi A. muciniphila a bakteriemi produkujícími butyrát může být přinejmenším v jednom případě oboustranná – Anaerobutyricum hallii prospívá A. muciniphila tím, že poskytuje pseudovitamin B12, kofaktor, který A. muciniphila potřebuje pro produkci propionátu (11).
V následujících kapitolách je popsáno několik mechanismů, kterými je hostiteli A. muciniphila prospěšná. Tyto pozitivní vlivy se mohou projevit na základě přítomnosti metabolitů nebo proteinů, které A. muciniphila sama produkuje, ale mohou být také důsledkem přítomnosti jiných zdraví prospěšných mikroorganismů, jejichž růst a metabolismus je umožněn tím, že A. muciniphila degraduje mucin.
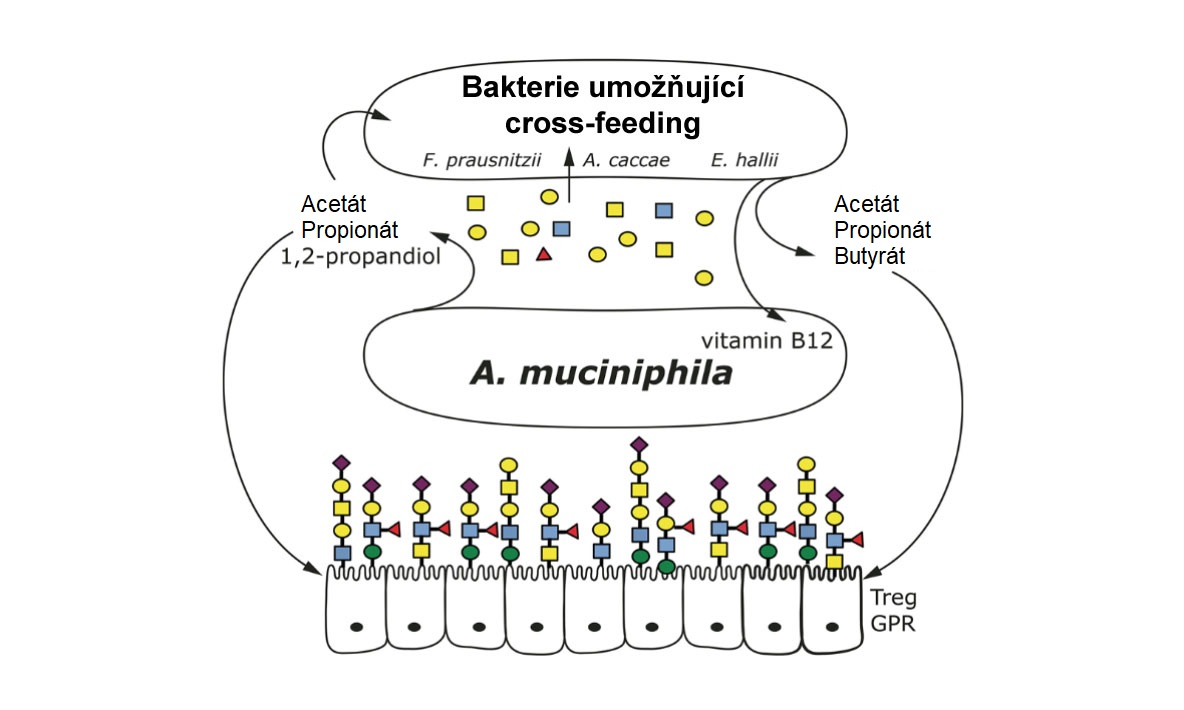
Obrázek 2: Schéma cross-feedingu mezi Akkermansia muciniphilia a dalšími kmeny včetně kmenů produkujících butyrát.
Zdroj: mBio, 2017 zaří-říjen; 8(5):e00770-17
A. muciniphila, střevní propustnost a imunitní homeostáza
Střevní imunitní homeostáza a úloha mikrobioty
Složení střevního imunitního systému
V lidském střevě se nacházejí biliony mikroorganismů a zároveň zde sídlí také největší imunitní systém. Střevní bariéra se skládá ze slizniční vrstvy, epitelové monovrstvy (obojí je popsáno výše) a lamina propria, vrstvy pojivových tkání pod epitelem (obr. 3). Hlen tvoří fyzickou bariéru mezi luminálními bakteriemi a epitelem a chemická bariéra je tvořena antimikrobiálními peptidy a imunoglobulinem A (zásadní protilátka, která obaluje napadající bakterie a chrání tak hostitele). Pod vrstvou hlenu jsou epitelové buňky pevně svázány proteiny těsného spoje – tyto proteiny regulují paracelulární transport, tj. přenos molekul mezi epitelovými buňkami z lumen do lamina propria. V epiteliální vrstvě se nacházejí také kontrolní imunitní buňky, které pomáhají buňkám v lamina propria zahájit útok ve chvíli, kdy jsou detekovány napadající patogeny, viz. následující kapitoly. Lamina propria obsahuje různé druhy imunitních buněk včetně regulačních T-buněk (Treg) vylučujících molekuly, které tolerují komenzály a připravují efektorové T-buňky na útok proti případným patogenům. Mezi efektorové T-buňky patří cytotoxické T-buňky, které mají za úkol napadat patogeny, a pomocné T-buňky, které rekrutují a aktivují další imunitní buňky. Pomocné T-buňky naopak rekrutují fagocyty (např. makrofágy a neutrofily), které pohlcují a usmrcují patogeny, a B-lymfocyty, které posilují imunitní systém produkcí různých tříd imunoglobulinů (protilátek).
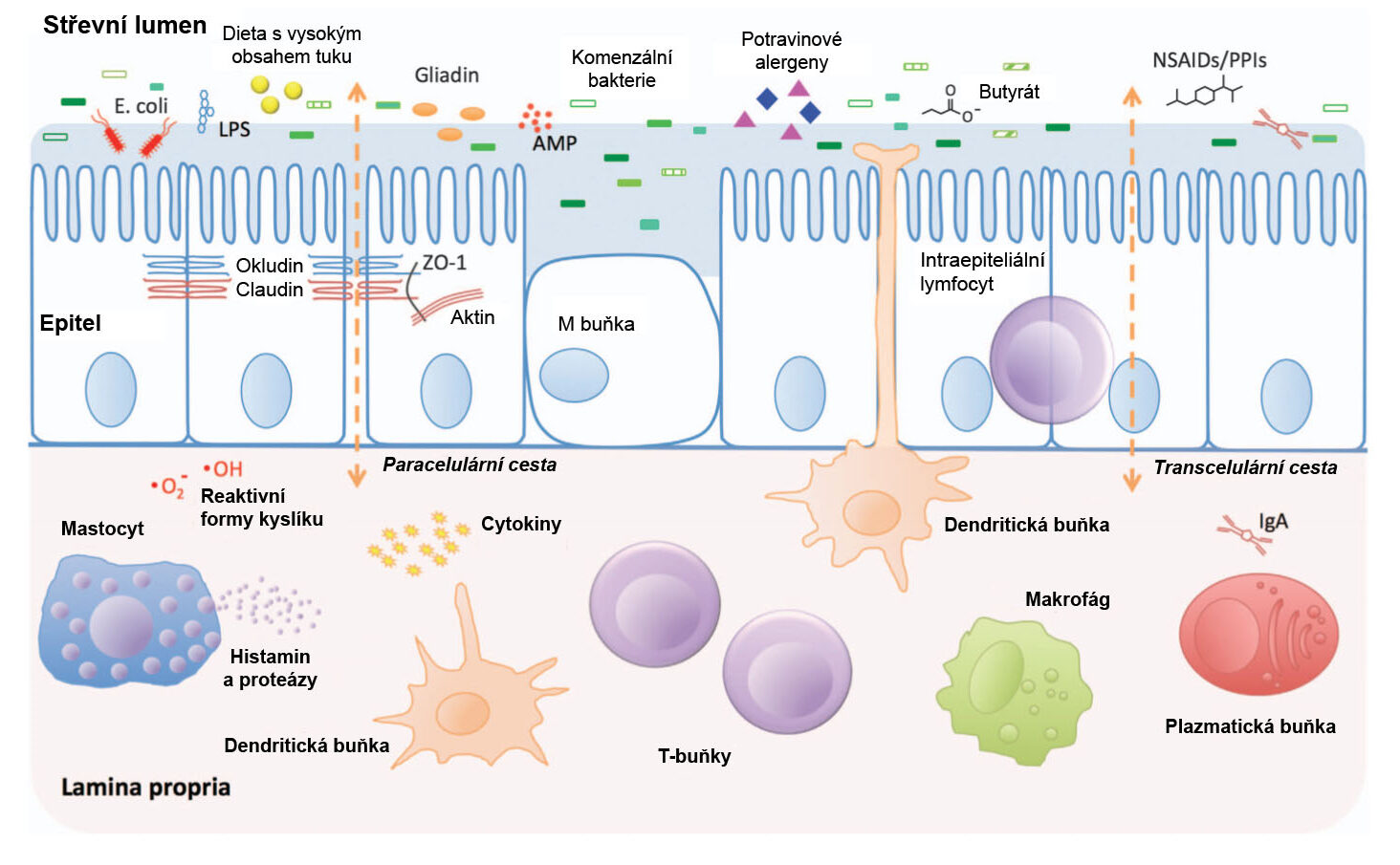
Obrázek 3: Struktura a složky střevní bariéry. Zdroj: König, J. et al. Clin. Transl. Gastroenterol 7, e196 (2016)
Střevní imunitní homeostáza je rovnováha mezi tolerancí a obranou
Střevní imunitní systém včetně slizniční bariéry a vrozeného a adaptivního imunitního systému udržuje rovnováhu mezi tolerancí komenzální mikrobioty a ochranou proti patogenům. Střevní mikrobi mají v rámci imunitní ochrany pomocí střevních epiteliálních buněk na starosti rozpoznávání molekulárních vzorů asociovaných s patogeny (PAMP). Příkladem PAMP jsou lipopolysacharidy (LPS), velké lipid-polysacharidové organismy na povrchu gramnegativních mikrobů (obr. 3). Střevní imunitní systém rozpoznává PAMP prostřednictvím speciálních receptorů označovaných jako pattern-recognition receptory (PRR), jako jsou např. Toll-like receptory (TLR) (14). Aktivace těchto receptorů kontinuální mikrobiální stimulací většinou vede k zánětu. V případě zdravé střevní homeostázy však střevní epitelové buňky udržují toleranci modulací sekrece antimikrobiálních peptidů a regenerací epitelu, přičemž komunikují s imunitními buňkami v lamina propria a udržují je v pohotovosti (15). Jiné imunitní buňky v lamina propria naopak vykazují profil potlačené zánětlivé odpovědi, což je charakterizováno vyšším množstvím regulačních T-buněk buněk a nižší koncentrací cytotoxických T-buněk. Když epitel zaznamená známky infekce, složení imunitních buněk se rychle přepne na prozánětlivý profil (16). V důsledku toho tak imunitní systém bojuje proti všem invazivním mikrobiálním metabolitům či fragmentům, čímž hostitele chrání. V kontextu chronické mikrobiální dysbiózy nebo střevní propustnosti může takové ochranné úsilí vést k problému střevní přecitlivělosti a chronického zánětu.
Střevní mikrobiota moduluje střevní imunitní systém
Bylo prokázáno, že střevní komenzální mikrobi modulují různé imunitní funkce. Studie zabývající se využitím antibiotik při léčbě myší odhalily, že absence komenzálního mikrobiomu ovlivňuje funkci slizniční bariéry snížením počtu Panethových buněk. Tyto buňky jsou zodpovědné za sekreci antimikrobiálních peptidů a za zajištění dostatečného množství pohárkových buněk, které mají na starosti sekreci mucinu (16). Bylo prokázáno, že kolonizace střeva některými komenzály, především z kmene Proteobacteria, zvyšuje koncentraci sérového imunoglobulinu A (IgA) a poskytuje ochranu před bakteriální sepsí (17). Kromě toho v případě léčby antibiotiky či bezbakteriálního stavu u myší se značně snížil počet regulačních T-buněk a pomocných Th17 buněk (17), čímž došlo ke snížení jejich účinku v případě imunosuprese a obrany proti infekci (18). Zároveň bylo prokázáno, že specifické složky komenzálních bakterií modulují diferenciaci T-buněk, přenos signálu a expresi cytokinů (19, 20). Vyvážená střevní mikrobiota je tedy klíčová pro udržení správně fungující střevní bariéry a imunitního systému.
A. muciniphila zlepšuje funkci střevní bariéry
Integrita střevní bariéry a endotoxémie u metabolických onemocnění
Narušení střevní bariéry vede ke zvýšené permeabilitě a následné translokaci mikrobiálních složek, např. LPS, do lamina propria (obr. 3). Přítomnost LPS v krvi, označovaná jako endotoxémie, je markerem střevní propustnosti a byla popsána u mnoha zánětlivých onemocnění, jako je např. zánětlivé onemocnění střev (IBD), syndrom dráždivého tračníku (IBS), obezita a diabetes. V případě, že se LPS dostane do krevního oběhu, může dojít ke spuštění prozánětlivé kaskády, která následně umožní progresi těchto onemocnění. Dle Caniho et al. je metabolická endotoxémie způsobena dietou s vysokým obsahem tuků a následnou změnou střevní mikrobioty, která vede k potlačení exprese proteinů těsných spojů a nakonec k inzulínové rezistenci (21). Restrukturalizace zdravého mikrobiomu a posílení integrity střevní bariéry proto může být jedním ze způsobů, jak zmírnit metabolická onemocnění vyvolaná endotoxemií.
A. muciniphila posiluje integritu střevní bariéry
Jak již bylo nastíněno výše, A. muciniphila se díky svým schopnostem využívat mucin k růstu a přímo se vázat na epiteliální buňky nachází v těsné blízkosti střevního epitelu. Existuje dostatek důkazů, že přítomnost A. muciniphila v této nice prospívá střevnímu epitelu hned několika způsoby. Ve studiích prováděných na myších se opakovaně prokazuje, že obnovení hojnosti A. muciniphila ve střevě pomocí dietních nebo farmaceutických zásahů snižuje sérové hladiny LPS, což zdůrazňuje pozitivní vliv A. muciniphila na funkci střevní bariéry (22–24).
V rámci zkoumání A. muciniphila byly identifikovány a testovány specifické složky, které účinně zvyšují integritu epiteliální bariéry in vitro a in vivo. Protein vnější membrány A. muciniphila připomínající pilus, Amuc_1100, zvyšuje transepiteliální elektrický odpor (TEER) v buňkách Caco-2 (25). Tato metoda kvantifikuje elektrický odpor přes monovrstvu epiteliálních buněk – zvýšený TEER znamená zlepšenou funkci bariéry, tj. epiteliální buňky tvoří těsnější bariéru a lépe chrání imunitní systém hostitele před stimulací. In vivo Amuc_1100 zlepšuje integritu bariéry měřenou hladinou LPS v plazmě a expresi proteinů těsných spojů (klaudin a okludin) (26) (obr. 4).
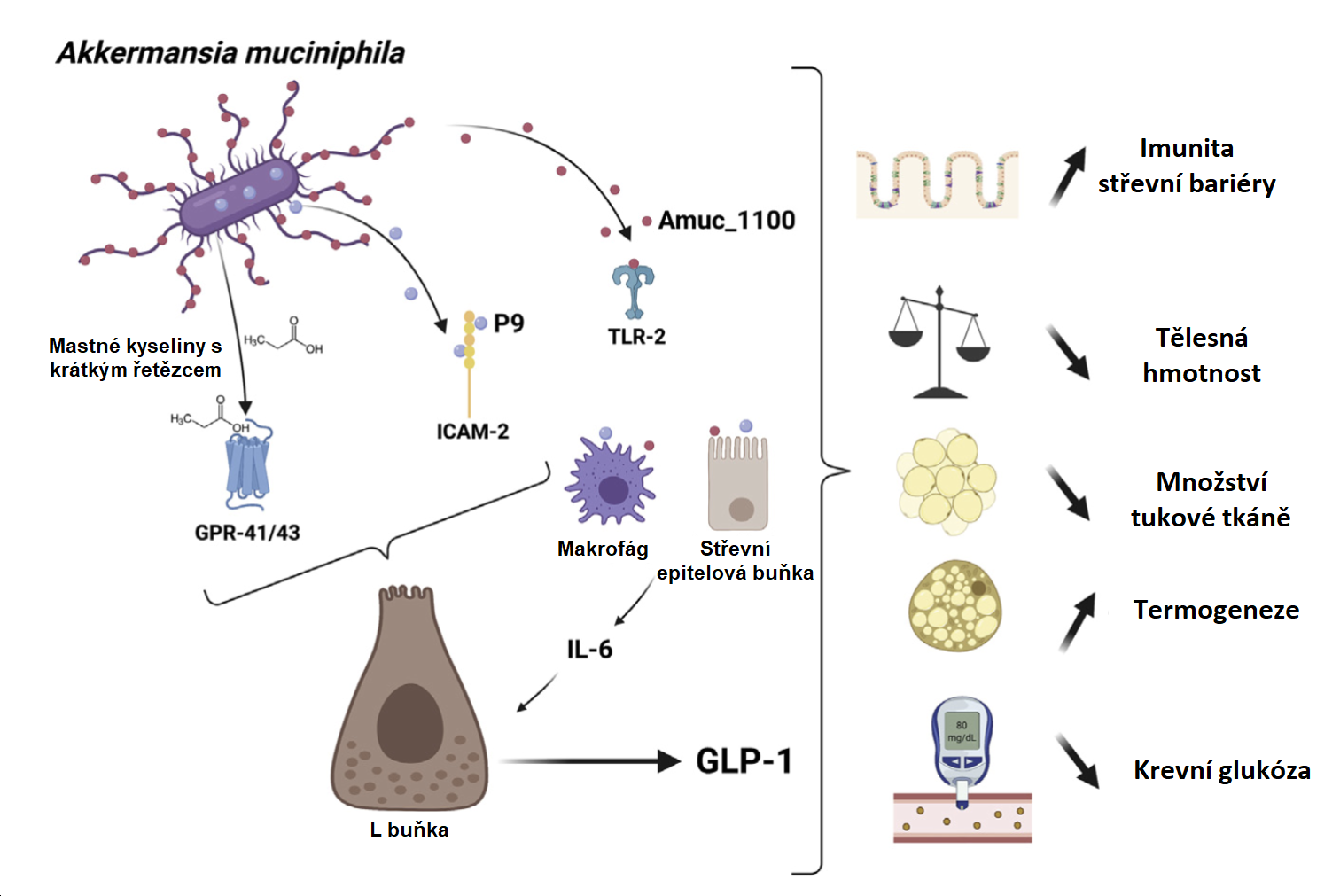
Obrázek 4: Biomolekuly produkované Akkermansia muciniphila a mechanismy jejich účinku.
Zdroj: Cani. P. D. a Knauf C., Cell Metab. 33. červen (2021)
Kromě toho bylo také prokázáno, že A. muciniphila uvolňuje extracelulární vezikuly (EV), které mají podobné vlastnosti napomáhající posilnění bariéry (27). EV jsou malé lipidové sférické částice, které mohou obsahovat různý buněčný náklad (proteiny, lipidy, nukleové kyseliny, metabolity). Chelakkot et al. prokázali, že částice EV bakterie A. muciniphila jsou u zdravých subjektů obohaceny a ochuzeny u pacientů s T2D27. Při testování myší s diabetes bylo dále prokázáno, že dieta s vysokým obsahem tuku zvyšuje střevní permeabilitu a snižuje expresi proteinů těsných spojů. V případě, že byly myším podávány EV A. muciniphila, byly tyto negativní účinky diety s vysokým obsahem tuku potlačeny. Toto zlepšení bylo potvrzeno i in vitro na linii střevních epiteliálních buněk Caco-2 – EV A. muciniphila se podařilo snížit permeabilitu vyvolanou LPS. A konečně, přímý perorální přídavek A. muciniphila u myší krmených aterogenní dietou s vysokým obsahem tuků zvýšil expresi několika proteinů těsných spojů (okludin a zonula occluden-1 (ZO-1)) v ileu, což je pravděpodobně důvodem současného snížení LPS v séru (28). I v tomto případě in vitro ošetření buněk Caco-2 pomocí A. muciniphila potvrdilo významné zvýšení regulace okludinu a proteinu těsných spojů 1, ZO-1.
A. muciniphila zesiluje tloušťku vrstvy střevní sliznice
Kromě přímých účinků na střevní epitelové buňky má A. muciniphila také schopnost modulovat tloušťku vrstvy hlenu. Jak již bylo nastíněno dříve, hlen tvoří primární hranici mezi buňkami hostitele a střevními mikroorganismy. Modulace vrstvy mucinu bakterií A. muciniphila tedy navíc přispívá ke zlepšení bariérové funkce. Obézní myši, kterým byly podávány polyfenoly nebo byly léčeny metforminem, vykazovaly spolu se zlepšením metabolické endotoxemie a zvýšeným výskytem A. muciniphila také zvýšený počet pohárkových buněk produkujících mucin. Zvýšený výskyt A. muciniphila se tedy pojí jednak se zvrácením poklesu pohárkových buněk a zároveň zastavuje zužování mucinové vrstvy, což jsou symptomy vyvolané dietou s vysokým obsahem tuků (23, 24). Dle Everarda et al. taková dieta u myší vede ke ztenčení vrstvy hlenu až o 46 %, avšak pomocí suplementace A. muciniphila je možné její tloušťku obnovit do zdravých rozměrů (22). Zároveň bylo zjištěno, že suplementace A. muciniphila u myší krmených dietou s vysokým obsahem tuku vedla k obnovení hustoty pohárkových buněk na úroveň myší krmených normální dietou (24). V obou těchto studiích suplementace A. muciniphila potlačila také metabolickou endotoxemii vyvolanou dietou s vysokým obsahem tuků.
Ochranná role A. muciniphila ve střevech u modelů neobézních onemocnění
Ochranný účinek A. muciniphila se neomezuje pouze na potíže vyvolané obezitou. Snížená exprese několika proteinů těsných spojů a narušení vrstvy hlenu se projevilo i u myší, kterým byl podáván ethanol. Tyto negativní účinky se podařilo potlačit léčbou A. muciniphila – suplementace A. muciniphila zvýšila expresi proteinů těsných spojů i počet pohárkových buněk (29). V modelu jaterního poškození iniciovaného T-buňkami zvýšila předběžná léčba A. muciniphila tloušťku mucinové vrstvy a expresi proteinů těsných spojů na vyšší úroveň, než je normální, což vedlo ke snížení jaterního poškození a zánětu (30). V modelu zrychleného stárnutí bylo podáváním A. muciniphila ztenčení tloušťky sliznice způsobené stárnutím velmi rychle zvráceno (31).
Lze tedy říci, že příznivé působení A. muciniphila na střevní epitel a na jeho schopnost působit jako nepropustná bariéra, která odděluje střevní lumen a jeho biliony mikroorganismů od tkáně hostitele, je v této chvíli již možné prokázat mnoha důkazy (obr. 4). A. muciniphila zlepšuje funkci epitelové bariéry přímou stimulací exprese proteinů těsných spojů v epitelových buňkách a také zvýšením počtu pohárkových buněk, čímž se zvyšuje i produkce mucinu. Tato zdravá bariéra tak zprostředkovává homeostázu imunitního systému, což vede ke zlepšení mnoha zdravotních ukazatelů.
A. muciniphila moduluje imunitní systém
A. muciniphila koreluje se snížením zánětlivých markerů u mnoha modelů onemocnění. Ačkoli je možné toto tvrzení částečně vysvětlit zvýšenou integritou střevní bariéry a metabolickou endotoxemií, jak již bylo uvedeno výše, některé studie se zaměřily také schopnost A. muciniphila modulovat vrozenou a adaptivní imunitní odpověď.
A. muciniphila moduluje vrozenou imunitní odpověď
Jako gramnegativní bakterie produkuje A. muciniphila LPS, známý endotoxin, který vyvolává prozánětlivou odpověď v hostitelských buňkách prostřednictvím signálních drah závislých na TLR4. Ottmanovi et al. se však podařilo prokázat, že A. muciniphila aktivuje další jedinečný vzorec signální transdukce. Kromě očekávané signalizace LPS-TLR4 vyvolává A. muciniphila signální dráhu závislou na TLR2, přičemž obě dráhy se sbíhají v aktivaci NF-kB, hlavního regulátoru zánětu25. Vnější membránový protein Amuc_1100, který byl již zmíněn výše v souvislosti s účinkem na těsné spoje, byl identifikován jako silný aktivátor TLR2 (obr. 4). Vysoké hladiny protizánětlivého cytokinu IL-10 byly prostřednictvím signalizace TLR indukovány jak živou A. muciniphila, tak i purifikovaným proteinem Amuc_1100. Oba stimuly následně indukovaly několik prozánětlivých cytokinů: IL-1b, IL-8, IL-6 a TNF-a. Tyto výsledky společně naznačují, že A. muciniphila může vyvolat jak prozánětlivé, tak protizánětlivé reakce. V další studii však A. muciniphila ze střevních epiteliálních buněk stimulovala IL-8 v mnohem menší intenzitě než E. coli, další gramnegativní střevní mikrob (10). Takový rozdíl v prozánětlivé odpovědi hostitele naznačuje, že A. muciniphila stimuluje vrozený imunitní systém natolik, aby jej udržovala v pohotovosti, a zároveň potlačuje zjevnou zánětlivou odpověď prostřednictvím mechanismů zahrnujících modulaci T-buněk.
A. muciniphila indukuje imunosupresivní regulační T-buňky
Komenzální mikrobi během homeostázy udržují adaptivní imunitní systém pod kontrolou tím, že udržují protizánětlivé regulační T-buňky. Tyto buňky fungují na základě přímé sekrece protizánětlivých cytokinů, jako je IL-10 nebo TGF-β, inhibují proliferaci, diferenciaci nebo aktivaci jiných imunitních buněk, a tím celkově potlačují zánět. Jejich vliv přesahuje oblast tlustého střeva a zasahuje systémové a periferní tkáně, například tukovou tkáň. Jedním z mechanismů, kterými A. muciniphila moduluje adaptivní imunitu, je indukce diferenciace regulačních T-buněk. Shin et al. uvedli, že suplementací A. muciniphila se podařilo potlačit expresi protizánětlivých cytokinů IL-6 a IL-1b ve viscerální tukové tkáni (VAT), která byla vyvolána dietou s vysokým obsahem tuku (24). Toto zjištění se pojí s daty, která vykazují zvýšenou infiltraci regulačních T-buněk do VAT a zvýšený počet pohárkových buněk ve střevě. Pohárkové buňky produkují nejen muciny, ale také tvoří průchody antigenů spojené s pohárkovými buňkami (GAP), kterými se luminální antigeny dostávají k dendritickým buňkám v lamina propria a následně přispívají k indukci a udržení regulačních T-buněk (32). Předpokládá se tedy, že A. muciniphila potlačuje zánět tukové tkáně zvýšením počtu pohárkových buněk, které prostřednictvím GAP indukují diferenciaci regulačních T-buněk.
A. muciniphila moduluje sekreci protilátek buňkami adaptivní imunity: IgA
U myší s fenotypem zrychleného stárnutí je možné pozorovat zhoršující se zdraví střevní bariéry, charakterizované ztenčením slizniční vrstvy a chronickým zánětem nízkého stupně. Suplementace A. muciniphila u takových myší vedla ke snížení prozánětlivých cytokinů a chemokinů v tlustém střevě, dále pak ke snížení produkce imunoglobulinů (tj. protilátek) a antimikrobiálních peptidů. Zajímavé je také to, že se snížil podíl aktivovaných B-buněk v Peyerových plátech tenkého střeva (31). Po aktivaci T-buňkami B-buňky produkují imunoglobulin a k této aktivaci dochází především v malých hrbolcích pod střevním epitelem, které se nazývají Peyerovy pláty. Snížená hladina aktivovaných B-buněk se současným snížením regulace imunoglobulinových genů naznačuje, že suplementace A. muciniphila snižuje potřebu ochrany slizniční bariéry. Pro ochranu sliznic jsou protilátky třídy IgA mimořádně důležité a jejich produkce je vyšší než produkce všech ostatních tříd imunoglobulinů dohromady. V souvislosti s hypersenzitivním střevním imunitním systémem, jako je tomu u stárnoucích střev nebo IBD, však může být příliš mnoho aktivovaných B-buněk a vysoká koncentrace IgA škodlivá. Výsledky této studie tedy naznačují, že A. muciniphila v případě stárnoucího zaníceného střeva zklidňuje imunitní systém prostřednictvím zvýšené produkce hlenu a snížené odpovědi B-buněk.
A. muciniphila moduluje sekreci protilátek buňkami adaptivní imunity: IgG
Na druhé straně Ansaldo et al. uvedli, že A. muciniphila je jedním z mála komenzálů, kteří jsou schopni vyvolat antigenně specifickou odpověď imunoglobulinu G (IgG) závislou na T-buňkách (33). Zatímco IgA hraje hlavní roli v ochraně střevní bariéry, třída protilátek IgG je spojena se systémovou antipatogenní efektorovou odpovědí T buněk. Předpokládá se, že malé množství antikomenzálních IgG posiluje v případě infekce a zánětu zánětlivou odpověď zprostředkovanou střevními T-buňkami (34). U myší s definovaným mikrobiomem (Altered Schaedler Flora) se však T-buňky specifické pro A. muciniphila výrazně přiblížily podobě T-folikulárních pomocných buněk, které následně napomáhaly aktivaci B-buněk. V reakci na to došlo ke zvýšení slizničních imunoglobulinů, což je obzvláště důležité vzhledem k tomu, že jiné kmeny vyvolávají u T-buněk zánětlivou efektorovou odpověď (35). Zajímavé je, že při přenesení na myši bez specifických patogenů (SPF) se T-buňky specifické pro A. muciniphila začaly chovat stejně jako efektorové T-buňky. Tato pozorování naznačují, že A. muciniphila dokáže formovat adaptivní imunitní systém tak, aby byl citlivý, ale přitom ne příliš zánětlivý. Důsledky těchto zjištění zatím nejsou jasné, ale poukazují na jedinečnou schopnost bakterie A. muciniphila vnímat skrze imunitní systém.
A. muciniphila potlačuje zánětlivou odpověď T-buněk: pomocné Th1 buňky
V modelu autoimunitního onemocnění jater jsou aktivovány T-buňky, které napadají jaterní buňky a vyvolávají zánět. Předběžná perorální léčba pomocí A. muciniphila v tomto modelu snížila množství odumírajících jaterních buněk a systémových zánětlivých molekul (30). Zatímco příznivé účinky A. muciniphila lze částečně vysvětlit zlepšením funkce střevní bariéry, změněný profil cytokinů (snížení produkce interferonu gama, IL-2 a TNF-α) naznačuje, že A. muciniphila pravděpodobně moduluje odpověď pomocných Th1 buněk. Reakce těchto buněk je typickou „bojovou“ odpovědí proti infekcím, při níž se zapojuje fagocytóza a zánětlivé cytokiny. V modelu onemocnění, kde je problémem nadměrná stimulace zánětu, může snížení tohoto typu odpovědi pomoci zmírnit negativní důsledky. Dá se tedy očekávat, že A. muciniphila bude schopna zabránit poškození jater potlačením odpovědi T-buněk, která připomíná autoimunitní reakci. Zároveň má potenciál poskytnout protizánětlivé účinky v případě podobných onemocnění zprostředkovaných reakcí T-buněk.
A. muciniphila a metabolismus hostitele
A. muciniphila zabraňuje přibývání na váze
Několik studií podporuje tvrzení, že A. muciniphila má antiobezogenní účinek. U myší krmených dietou s vysokým obsahem tuků vedlo podávání živé A. muciniphila k 50% snížení přírůstku tělesné hmotnosti v porovnání s podáváním bakterie ve stavu tepelné inaktivace. Podávání živé bakterie zároveň vedlo ke snížení obsahu viscerálního a podkožního tuku a velikosti jednotlivých adipocytů (22, 26, 36). Toto zjištění se týkalo myší náchylných k obezitě, které byly krmeny dietou s vysokým obsahem tuků a cukrů; podávání živé A. muciniphila významně snížilo přírůstek hmotnosti a tělesného tuku (37). Zajímavé je, podobné ochranné účinky na tělesnou hmotnost a množství tuku měla i pasterizovaná A. muciniphila, extracelulární vezikuly A. muciniphila a purifikovaný protein Amuc_1100 (26, 27). Suplementace pasterizovanou A. muciniphila také zvýšila kalorický obsah výkalů, což znamená, že tyto myši absorbovaly ze stravy méně energie (26). Střevní absorpční funkce se zvýšila v případě, že byly myši dlouhodobě vystavovány chladu, čímž byl maximalizován i příjem kalorií z potravy. Důležité je, že tato změna byla způsobena snížením množství A. muciniphila, protože suplementace A. muciniphila v takových podmínkách by mohla zvrátit zvýšení příjmu kalorií vyvolané chladem. Dalo by se tedy říci, že zvýšení množství A. muciniphila může vést ke snížení přijaté energie ze stravy (38).
Zvýšení tělesné hmotnosti a tukové hmoty v důsledku diety s vysokým obsahem tuků má také za následek zhoršenou regulaci glukózy a inzulinovou rezistenci. Ve střevě myší trpících obezitou způsobenou dietou je zároveň možné pozorovat snížený výskyt A. muciniphila. V takovém případě suplementace živou A. muciniphila, pasterizovanou A. muciniphila nebo purifikovaným proteinem A. muciniphila vede k lepší glukózové toleranci a zlepšení inzulinové rezistence. Tyto mechanismy jsou popsány v následující části (22, 24, 26).
Modulace inzulinové rezistence a zánětu
Inzulinová rezistence a orgánová dysfunkce
Jedním z hlavních následků obezity a diabetu je dysregulace metabolismu. V důsledku nadbytku živin a hyperglykémie dochází v důležitých metabolických orgánech (játra, tukové tkáně a kosterní svaly) k narušení inzulinové signalizace, což je jev označovaný jako inzulinová rezistence (39). V důsledku toho jsou dysfunkce metabolických orgánů běžnou komorbiditou obezity a diabetu a termín metabolický syndrom zahrnuje všechny příznaky týkající se těchto orgánů. Játra produkují glukózu v neomezeném množství a svaly společně s tukovou tkání ztrácejí schopnost glukózu přijímat, což obojí přispívá k hyperglykémii. Adipocyty, zahlcené příliš velkým množstvím hromadícího se tuku, neustále uvolňují do oběhu volné mastné kyseliny. Tyto mastné kyseliny se hromadí v játrech a svalové tkáni ve formě triglyceridů. Nadměrné množství tuku v játrech vede k zánětu a další produkci glukózy. Tuk, se kterým si játra nedokážou poradit, se přelévá do krve a svalů, čímž se cyklus opakuje. K tomu se přidává příliš vysoká hladina cirkulujícího inzulínu, který signalizuje játrům, aby produkovala ještě více tuku. Tyto změny je možné pozorovat u myší s obezitou a cukrovkou vyvolanou dietou s vysokým obsahem tuku. Zajímavé je, že analýza druhů střevních bakterií ukazuje, že množství A. muciniphila se postupně snižuje v souvislosti s progresí fenotypu obezity, což negativně ovlivňuje nejen tělesnou hmotnost, ale také parametry inzulinové rezistence, cirkulující glukózy, metabolismu tukové tkáně a zánětu. Otevírá se tedy pro výzkum otázka, jakou hraje A. muciniphila roli z hlediska všech aspektů metabolismu hostitele (40).
A. muciniphila v metabolismu tukové tkáně
Studie suplementace A. muciniphila u myší s obezitou a diabetem ukázaly, že A. muciniphila má schopnost zvrátit poruchy v metabolismu lipidů. V několika studiích se prokázalo, že v reakci na živé, pasterizované či purifikované bílkoviny A. muciniphila dochází ke snížení cirkulujících triglyceridů (22, 26). Tento účinek je možné považovat za známku navrácení normální funkce ukládání tuků tukovou tkání v důsledku korekce inzulinové signalizace, což dokládá zvýšená exprese genů oxidace mastných kyselin v tukové tkáni (22) (obr. 4). Kromě zlepšení metabolismu tukové tkáně vykazuje A. muciniphila také účinek na zmírnění zánětu v tukové tkáni. Expanze adipocytů během obezity přispívá ke vzniku zánětu skrze inzulinovou rezistenci, zvýšenou infiltraci tkáně makrofágy a zvýšenou expresi prozánětlivých molekul. Kromě zvýšení citlivosti na inzulin se ukázalo, že A. muciniphila zvyšuje infiltraci protizánětlivých regulačních T-buněk, snižuje zánětlivé reakce tukové tkáně a snižuje systémovou hladinu prozánětlivých cytokinů (24).
A. muciniphila v jaterním metabolismu
A. muciniphila moduluje také metabolismus lipoproteinů a glukózy v játrech. Přebytečné triglyceridy, které pocházejí buď z potravy nebo z endogenní syntézy, jsou prostřednictvím specializovaných struktur zvaných lipoproteiny transportovány do jater, kde jsou odstraňovány skrze receptory lipoproteinů o nízké hustotě (LDL). Na modelu myší s nadbytkem cirkulujících triglyceridů se prokázalo, že A. muciniphila podporuje odstranění akutního zvýšení perorálně podávaných triglyceridů tím, že indukuje expresi jaterních LDL receptorů. Zvýšená exprese LDL receptorů v játrech následně zvyšuje vychytávání lipoproteinů bohatých na triglyceridy z cirkulace. V tomto modelu bylo mimo jiné možné pozorovat také to, že chronická hypertriglyceridemie negativně ovlivňuje toleranci glukózy. Na základě podávání A. muciniphila došlo ke zlepšení postprandiální hladiny glukózy v plazmě, což potvrzuje tvrzení, že metabolismus lipidů a glukózy je úzce propojen. Na základě suplementace A. muciniphila u myší krmených dietou s vysokým obsahem tuků bylo možné pozorovat ve stavu nalačno sníženou hladinu glukózy (22). Současně byla snížena i jaterní exprese glukóza-6-fosfatázy, enzymu podílejícího se na produkci glukózy. V neposlední řadě se ukázalo, že suplementace A. muciniphila má vliv na snížení poškození jater vyvolaného jak dietou s vysokým obsahem tuků, tak autoimunitní reakcí zprostředkovanou T-buňkami, což bylo zjištěno na základě zkoumání hladin aminotransferáz běžně spojovaných se sníženou funkcí jater (28, 30).
A. muciniphila při systémovém zánětu
Modulace metabolické dysfunkce a zánětu v tukové tkáni a játrech, stejně jako ve střevní bariéře popsané v předchozí části, přispívá k systémové regulaci zánětlivých faktorů. Bylo prokázáno, že v důsledku suplementace A. muciniphila dochází u mnoha modelů onemocnění ke snížení cirkulujících prozánětlivých cytokinů a chemokinů, biomarkerů poškození jater, volných mastných kyselin a triglyceridů (24, 26, 30, 31, 41–44). Protizánětlivé účinky A. muciniphila však nejsou omezeny pouze na léčení patologického stavu. U myší krmených standardní dietou dokázala suplementace A. muciniphila zvýšit citlivost na inzulin, snížit endotoxemii a zmírnit stres endoplazmatického retikula v játrech, svalech a střevech a zároveň zvýšit cirkulující hladiny protizánětlivých metabolitů α-tokoferolu a β-sitosterolu (45). Je tedy možné říci, že A. muciniphila prospívá metabolické i imunitní homeostáze modulací vzájemně závislých lokalizovaných a systémových drah.
Modulace signálních molekul hostitele: inkretiny a endokanabinoidy
Inkretiny jsou hormony regulující hladinu glukózy uvolňované endokrinními buňkami usazenými ve střevním epitelu, obvykle po požití živin. Dále mají na starosti také sekreci inzulinu ze slinivky břišní po zaznamenání přísunu živin. Inkretinový efekt označuje inzulinovou odpověď, která je vyvolána perorálním požitím glukózy. Tato odpověď je ve srovnání s intravenózním podáním glukózy výrazně zvýšená, nicméně právě intravenózní podání zdůrazňuje úlohu inkretinů. U obézních a diabetických pacientů je inkretinový efekt oslaben, pacienti vykazují snížené hladiny postprandiálního peptidu podobného glukagonu 1 (GLP-1). GLP-1 je hlavní inkretin vnímaný nejen receptory ve slinivce břišní, ale také v tukové tkáni, svalech a v centrálním nervovém systému. Jeho signální účinek se tak neomezuje pouze na stimulaci sekrece inzulinu a inhibici glukagonu ve slinivce břišní. Mezi známé účinky GLP-1 patří snížená chuť k jídlu, zpomalený tranzit potravy žaludkem, zvýšený příjem glukózy periferními orgány a snížená produkce glukózy játry, což přispívá ke zlepšení účinku inzulinu a snížení hladiny glukózy v krvi. Některé přístupy k léčbě diabetu se soustředí na způsoby, jak zvýšit postprandiální hladiny GLP-1 v krvi, a to prostřednictvím analogů GLP-1, agonistů receptorů GLP-1 a inhibitorů enzymů inaktivujících GLP-1. Nedávné studie naznačují, že ke zvýšení uvolňování GLP-1 může dojít i na základě manipulace se střevním mikrobiomem. Prebiotická léčba u obézních myší zvýšila hladinu A. muciniphila, na základě čehož došlo ke zvýšení počtu L-buněk (střevních endokrinních buněk zodpovědných za sekreci GLP-1) a také portální plazmatické hladiny GLP-1 (46). A. muciniphila navíc vytváří propionát, mastnou kyselinu s krátkým řetězcem, který stimuluje sekreci GLP-1 L-buňkami prostřednictvím receptorů pro volné mastné kyseliny (FFAR2 a FFAR3) (47) (obr. 4). Dále bylo prokázáno, že detekce propionátu prostřednictvím FFAR3 aktivuje střevní glukoneogenezi a podporuje energetickou homeostázu (48).
Dalším důležitým prvkem pro fyziologii hostitele je endokanabinoidní (eCB) systém. Skupinu bioaktivních lipidů (endokanabinoidů) tento systém vnímá pomocí dvou hlavních receptorů (CB1 a CB2) a následně iniciuje řadu reakcí, které přispívají k homeostáze glukózy a lipidů, regulaci energetického metabolismu, střevní permeabilitě, zánětu a metabolické endotoxemii. Tento systém, již rozsáhle popsán jinými autory (49), ovlivňuje mnoho aspektů fyziologie hostitele a hraje významnou roli v oblasti metabolických poruch. Suplementace A. muciniphila u myší krmených dietou s vysokým obsahem tuků vedla ke zvýšení výskytu několika endokanabinoidů – 2-oleoylglycerolu (2-OG), 2-arachidonoylglycerolu (2-AG) a 2-palmitoylglycerolu (2-PG) – a také ke snížení střevní propustnosti, metabolické endotoxemie a zlepšení metabolických poruch, jak již bylo uvedeno výše (22). Předpokládá se, že zvýšená produkce těchto endokanabinoidů částečně vysvětluje mechanismus, který stojí za schopností A. muciniphila zlepšovat metabolické parametry. U endokanabinoidu 2-AG byla již dříve prokázána schopnost snížit u myší metabolickou endotoxemii a systémový zánět (50), endokanabinoid 2-OG naopak podporuje sekreci GLP-1 střevními enteroendokrinními buňkami (51).
Membránový P9 protein, nový kandidát zodpovědný za příznivé účinky A. muciniphila na homeostázu glukózy a metabolická onemocnění
Yoon et al. (Nature Microbiology, 2021) nedávno identifikovali nový protein, který bakterie A. muciniphila vylučuje. Vědcům se podařilo prokázat, že u myší tento protein o hmotnosti 84 kDa zvyšuje termogenezi, snižuje obezitu a inzulinovou rezistenci vyvolanou dietou a zvyšuje také cirkulující GLP-1 (obr. 4). Perorální podávání P9 snížilo přírůstek tělesné hmotnosti a nárůst tukové hmoty a zvýšilo střevní expresi proglukagonu. Dále bylo zjištěno, že P9 interaguje s mezibuněčnou adhezní molekulou 2 (ICAM-2) a celý tento mechanismus je závislý na interleukinu-6. Jedná se o slibné výsledky, které je však stále třeba ověřit u lidí. Prozatím poukazují na schopnosti A. muciniphila produkovat soubor odlišných molekul, dále pak mastné kyseliny s krátkým řetězcem, protein AMUC_1100 a mimo jiné vylučovaný protein P9. Jedná se o látky napomáhající snížení tělesné hmotnosti tukové hmoty a glykémie a zároveň mají pozitivní vliv na funkci střevní bariéry a imunity.
A. muciniphila v klinických údajích použití u lidí: spojitosti a příčinné souvislosti
Obezita a úbytek hmotnosti
Od roku 2007 byla skrze četné observační studie provedené na lidských subjektech zjištěna korelace mezi množstvím A. muciniphila a metabolickými onemocněními. Hladiny A. muciniphila byly měřeny pomocí sekvenování genu 16S rRNA nebo skrze kvantitativní PCR (qPCR) vzorky stolice. Na základě těchto testů byla zjištěna negativní korelace s obezitou a prokázalo se, že výsledky se vztahují ke všem věkovým skupinám. Zhang et al. v observační studii zaznamenali nižší výskyt A. muciniphila u obézních dospělých subjektů ve srovnání s dospělými se zdravou hmotností (52). Santacruz et al. a Karlsson et al. uvádějí nižší výskyt A. muciniphila také u obézních těhotných žen a obézních dětí ve srovnání se zdravými subjekty (53, 54). Zajímavé je, že hladiny A. muciniphila zároveň korelují s úrovní aktivity subjektů a jejich fyzickou zdatností. Clarke et al. ve své observační studii porovnávali hladiny A. muciniphila u vrcholových sportovců a běžných subjektů s vysokým i nízkým BMI (55). Ačkoli vrcholoví sportovci neměli nízké BMI, vědci u nich zaznamenali vyšší hladiny A. muciniphila ve srovnání s muži v kontrolní skupině s vysokým BMI, což naznačuje vztah mezi hladinami A. muciniphila, fyzickou aktivitou a stravou (55).
Intervenční studie zaměřené na stravu mimo jiné zkoumaly také korelaci mezi koncentrací A. muciniphila a úbytkem hmotnosti u kontrolních a exponovaných subjektů. Kim a kol. zaznamenali pozitivní korelaci mezi množstvím A. muciniphila a úbytkem hmotnosti subjektů po léčbě tradiční léčivou bylinou Ephedra sinica (56). V dietní intervenční studii obézních dospělých Dao et al. zjistili, že výskyt A. muciniphila souvisí se zlepšením metabolického stavu a klinických výsledků (57). Nediabetici s nadváhou a obezitou podstoupili šestitýdenní dietu s omezeným příjmem kalorií obohacenou o bílkoviny a vlákninu, po níž následovala šestitýdenní dieta pro stabilizaci hmotnosti. Ze vzorků stolice bylo pomocí metagenomiky a qPCR analyzováno množství bakteriálních genů. Výsledky ukázaly, že osoby s vyšším obsahem A. muciniphila na začátku studie vykazovaly celkově zdravější metabolický stav, který byl měřen na základě poměru pasu a boků a hladiny leptinu a glukózy v krvi nalačno. Skupina s vysokým obsahem A. muciniphila také vykazovala menší velikost adipocytů. Po absolvování diety s omezeným příjmem kalorií a následné stabilizaci hmotnosti mezi skupinami s vysokým a nízkým obsahem A. muciniphila nebyl zaznamenán žádný rozdíl v úbytku hmotnosti. Skupina, u níž se A. muciniphila vyskytovala ve vysoké koncentraci, vykazovala další markery lepšího metabolického zdraví, např. nižší hladinu glukózy v krvi57. Výsledky těchto studií jsou paralelní se studiemi, které byly provedeny na zvířatech. V obou případech A. muciniphila jasně přispívá k udržování metabolického zdraví.
Diabetes a inzulinová rezistence
Na základě výsledků ze studií na zvířatech se vědci zaměřili na lidské subjekty, konkrétně na porovnání množství A muciniphila u zdravých dospělých osob, dále u osob ve stavu přecházejícím diabetu a u dospělých diabetiků, což naznačuje, že poměr A. muciniphila ovlivňuje citlivost na inzulin a diabetes mellitus 2. typu (DM 2. typu). Zhang et al. měřili množství bakterií pomocí sekvenování 16S rRNA ve vzorcích stolice prediabetiků a nově diagnostikovaných diabetiků. U prediabetiků a diabetiků výsledky prokázaly snížený výskyt A. muciniphila ve srovnání se zdravými subjekty, přičemž ve skupině prediabetiků byl výskyt o něco nižší než ve skupině nově diagnostikovaných diabetiků (58). To naznačuje, že nízké hladiny A. muciniphila by mohly být markerem progrese DM 2. typu. Chelakkot et al. se zaměřili konkrétně na výzkum extracelulární vezikuly (EV) A. muciniphila a zaznamenali, že tyto vezikuly se u zdravých osob vyskytují oproti diabetikům ve větší míře (27). Jak již bylo uvedeno výše, vědci skrze in vitro výzkum EV zjistili zlepšení funkce těsných spojů v modelu střevní permeability, což poukazuje na možný mechanismus účinku A. muciniphila. Díky těmto studiím bylo potvrzeno, že nízké hladiny A. muciniphila úzce souvisí s progresí diabetu.
Klinické studie prováděné na lidech
První studii pro ověření koncepce suplementace A. municiphila u lidských subjektů provedli Depommier et al. (59). Vědci na základě zjištění uvedli, že u lidí je možné bezpečně tolerovat obsah 10 (10) KTJ bakterií. Subjektům s inzulinovou rezistencí a nadváhou či obezitou byly denně po dobu tří měsíců podávány bakterie A. muciniphila v živé podobě, nebo v pasterizované podobě. Třetí skupině bylo podáváno placebo. Ukázalo se, že živá A. muciniphila zlepšila stav inzulinové rezistence a snížila markery jaterní dysfunkce a zánětu. Pasterizované bakterie zvýšily hladinu inzulinu, zlepšily inzulinovou rezistenci a snížily celkový cholesterol. Ve skupině subjektů léčených pasterizovanými bakteriemi bylo pozorováno mírné snížení tukové hmoty a celkové tělesné hmotnosti. Zároveň tyto subjekty vykazovaly nižší zánětlivé markery ve srovnání s těmi, které dostávaly živé bakterie (59). Rozdíly pozorované u živých a pasterizovaných bakterií A. muciniphila naznačují rozdílné mechanismy účinku a ukazují, že v této oblasti je třeba provést další výzkum s využitím větších vzorků. Ačkoli otázky mechanismů účinku zůstávají otevřené, tato studie poukázala na potenciál A. muciniphila stát se probiotikem nové generace se schopností nejen podpořit zdraví, ale obzvláště pomoci při řešení metabolických onemocnění.
Zásahy ke zvýšení početnosti A. muciniphila
Jak již bylo uvedeno výše, zvýšený obsah A. muciniphila ve střevě je spojen s řadou pozitivních vlivů na metabolismus a celkové zdraví hostitele. Z toho důvodu se také zvedá zájem o řadu změn a nových přístupů, ať už dietních či lékařských, které mají potenciál zvýšit koncentraci A. municiphila v lidském organismu a zpřístupnit tak mnohé pozitivní vlivy na zdraví, které tato bakterie přináší.
Probiotika
Studie na zvířatech potvrdily, že přímá perorální suplementace živou A. muciniphila zvyšuje její množství ve střevě, což má pozitivní účinek na zdraví. Tři intervenční studie na myších aplikované na dva různé modely prokázaly, že po suplementaci A. municiphila se výskyt této bakterie ve střevech a/nebo výkalech myší zvýšil (22, 24, 28). Jak již bylo uvedeno výše, v nedávné době bylo provedeno testování suplementace A. muciniphila také na lidských subjektech. Výsledky ukazují, že suplementace živé bakterie u lidí významně zvýšila její množství v porovnání s výsledky pacientů, kterým bylo podáváno placebo (59). Zajímavé je, že ke 100násobnému zvýšení množství A. muciniphila ve výkalech obézních myší krmených dietou s vysokým obsahem tuků vedlo také podávání probiotické směsi kmene Lactobacillus rhamnosus LMG S-28148 a Bifidobacterium animalis subsp. lactis LMG P-28149. Tento účinek byl později připsán kmeni Bifidobacterium animalis (60). Pedret et al. potvrdili tyto výsledky u lidí zjištěním, že ke zvýšení hladiny A. muciniphila u obézních jedinců vedlo i perorální podávání dalšího kmene Bifidobacterium animalis subsp. Lactis (CECT 8145) po dobu 3 měsíců. Autoři této studie považují zvýšení hladiny A. muciniphila jako možný důvod pro zlepšení metabolických parametrů, které léčená skupina vykazovala (61)
Dietní intervence
Strava je klíčovým faktorem pro složení, rozmanitost a funkčnost střevního mikrobiomu hostitele a otázka modulace střevní mikrobioty prostřednictvím stravy byla již rozsáhle popsána (62). V kontextu růstu schopnosti podpořit růst A. muciniphila byly zkoumány různé dietní zásahy, od omezení příjmu kalorií až po příjem specifických živin. Studie na zvířatech i lidech konzistentně ukazují, že strava s vysokým obsahem tuků je v nepřímé korelaci s množstvím A. muciniphila a její množství má taková strava potenciál snižovat (22, 60, 63). Na druhou stranu nízkoenergetická strava může početnost A. muciniphila zvyšovat. Podobně jako výsledky u hladovících myší, i studie provedené na lidech prokázaly, že na hladinu A. muciniphila kladně působí půst (64). Medina-Vera et al. dále zjistili, že u pacientů s DM 2. typu dieta se sníženým obsahem energie v kombinaci se zvýšeným příjmem funkčních potravin (rozpustné vlákniny, omega-3 mastných kyselin atd.) po dobu 12 týdnů zvýšila množství A. muciniphila o 125 % (65). Dvě další diety s omezeným přísunem energie, makrobiotická dieta Ma-Pi 2 bohatá na vlákninu a „řízená“ dieta doporučovaná italskými zdravotníky pro léčbu diabetu, u pacientů s DM 2. typu rovněž vedly ke zvýšení A. muciniphila (66).
Jak dokládají výše citované studie, velká část výzkumu týkajícího se dietní intervence se zaměřuje na zvýšený příjem vlákniny, tedy na sacharidy, které hostitel nemůže strávit a vstřebat. Tyto sacharidy tedy zůstávají k dispozici pro mikrobiální hydrolýzu a fermentaci ve střevě. Prebiotikum je vláknina, která je selektivně využívána určitými střevními mikroby a je prospěšná zdraví hostitele (67). Příkladem prebiotika jsou například fruktooligosacharidy (FOS). Jedná se o prebiotika rostlinného původu, které se nachází mimo jiné v čekance, banánech, artyčoku a chřestu. Everard et al. prokázali u obézních myší krmených dietou bohatou na FOS nárůst A. muciniphila, přičemž u myší krmených takovou dietou se oproti kontrolní dietě počet A. muciniphila zvýšil >80krát (46). Tyto výsledky byly potvrzeny i v navazující studii, kdy u myší krmených dietou s vysokým obsahem tuků byl výskyt A. muciniphila 100krát nižší a u obézních myší s deficitem leptinu byl výskyt A. muciniphila snížen 3300krát. U obou skupin se na základě suplementace FOS výskyt A. muciniphila obnovil na kontrolní úroveň (22). Podobné zvýšení A. muciniphila po suplementaci FOS bylo pozorováno u samců laboratorních potkanů Sprague-Dawley (68). U hlodavců krmených dietou s vysokým obsahem tuků zabránilo poklesu A. muciniphila podávání mangové dužiny, dalšího zdroje vlákniny (63). Bylo také prokázáno, že dvě další prebiotické vlákniny, inulin a polydextróza, zvyšují množství A. muciniphila jednak u pacientů s nadváhou/diabetem, ale také u zdravých dospělých mužů (69, 70). Další běžnou součástí stravy, o níž je známo, že významně ovlivňuje střevní mikrobiom, je obsah FODMAP. FODMAP označuje „fermentovatelné oligo-, di- a monosacharidy a polyoly“, cukry a cukerné alkoholy, které se ve střevě špatně vstřebávají a střevním mikrobiomem jsou snadno fermentovány, což vede ke zvýšené produkci plynů a příznakům funkční střevní poruchy, mezi které patří nadýmání. Z tohoto důvodu byla dieta s nízkým obsahem FODMAP označena za možnou léčbu syndromu dráždivého tračníku (IBS). Halmos et al. prokázali skrze dvě různé dietní intervenční studie provedené na lidských subjektech, že snižování obsahu FODMAP ve stravě snižuje početnost A. muciniphila (71), (72). Ačkoli mechanismy jsou prozatím nejasné, je zřejmé, že strava je důležitým regulátorem množství A. muciniphila a že konzumace vlákniny zdraví prospěšnou hladinu A. muciniphila ve střevě může stimulovat.
Další skupinou živin studovaných v souvislosti se stimulací A. muciniphila jsou polyfenoly, sekundární metabolity rostlinného původu s antioxidačními a protizánětlivými vlastnostmi. Mezi potraviny bohaté na polyfenoly patří ovoce a zelenina, čokoláda, čaje, káva a víno a různé druhy obilovin(73). Střevo polyfenoly vstřebává v různém množství, a proto jsou pro střevní mikroflóru do jisté míry dostupné (74). Skrze studie prováděné na zvířatech bylo prokázáno, že početnost A. muciniphila zvyšují výtažky z brusinek, granátového jablka, zeleného čaje a dalších polyfenolů (23, 75–78). Anhê et al. zkoumali ochranné účinky brusinkového extraktu na modelech metabolických onemocnění. Zvýšení hladiny A. muciniphila ve stolici a snížení cirkulujícího LPS v plazmě se u myší krmených dietou s vysokým obsahem tuku/vysokým obsahem sacharózy prokázalo po léčbě brusinkovým extraktem (23). Tyto myši také vykazovaly zlepšenou citlivost na inzulin ve srovnání s kontrolními skupinami, což naznačuje souvislost mezi polyfenoly brusinkového extraktu a A. muciniphila. Dalším bohatým zdrojem polyfenolů jsou hrozny. Roopchand et. al. uvedli, že u myší s obezitou způsobenou dietou extrakt z hroznů zvýšil množství A. muciniphila a zároveň došlo ke snížení zánětu a hmotnosti, dále pak množství tuku. Zároveň se zlepšila glukózová tolerance a funkce střevní bariéry (76).
V další studii bylo zjištěno, že u myší krmených dietou s vysokým obsahem tuku mění konzumace celých hroznů střevní mikrobiotu a zároveň dochází ke zlepšení metabolických markerů. V případě hladiny A. muciniphila však nebyly pozorovány žádné změny (79). Na základě výzkumů byly navrženy přímé i nepřímé mechanismy působení polyfenolů. Anhê et al. dále prokázali zvýšení markerů pohárkových buněk tlustého střeva a exprese mRNA MUC2 u myší, kterým byl podáván brusinkový extrakt, což naznačuje, že polyfenoly zvyšují produkci mucinu za účelem zvýšení růstu A. muciniphila (23). Zajímavý přístup zvolili Garcia-Villalba et al. – v rámci výzkumu byl použit simulovaný model střeva, na kterém vědci prokázali, že polyfenoly z granátového jablka zvyšují prevalenci Akkermansia přímo tím, že působí jako prebiotikum (80). Navzdory již provedeným studiím je v oblasti mechanismů jejich působení na výskyt A. muciniphila zapotřebí dalšího výzkumu, aby bylo možné zdraví prospěšné účinky polyfenolů efektivně využít.
Metformin
Metformin (dimethylbiguanid) je nejrozšířenějším lékem na DM 2. typu, který udržuje zdravou hladinu cukru a nevyvolává hypoglykémii. Díky svým protizánětlivým vlastnostem byla účinnost metforminu zjištěna i u řady nediabetických pacientů, kteří trpí např. kardiovaskulárním onemocněním, syndromem polycystických vaječníků, zánětem souvisejícím s HIV nebo rakovinou (81). Pozoruhodné je, že metformin moduluje složení střevního mikrobiomu a zvyšuje také množství A. muciniphila. Několik studií na myších krmených dietou s vysokým obsahem tuků prokázalo při podávání metforminu spolu se zlepšením metabolismu také zvýšení množství A. muciniphila (24, 82, 83). Léčba metforminem u pacientů s DM 2. typu rovněž změnila střevní mikrobiotu a významně zvýšila množství A. muciniphila, mimo jiné také došlo k zlepšení regulace glukózy. Fekální transplantace této „metforminem změněné mikrobioty“ do bezmikrobních myší zlepšila jejich glukózovou toleranci oproti myším, které dostávaly „mikrobiotu před léčbou metforminem“ (84).
Vědci navíc při in vitro výzkumu prokázali, že přidání metforminu do média na kultivaci mikroorganismů podporuje růst A. muciniphila (84). To poukazuje na fakt, že změny střevního mikrobiomu a množství Akkermansia muciniphila se současným zlepšením funkce střevní bariéry a snížením zánětu jsou možným mechanismem účinku metforminu.
Zjištění společnosti Pendulum
Abstrakty nejnovějších publikací, které zahrnují bakterii Akkermansia muciniphila:
Zlepšení postprandiální regulace glukózy u osob s diabetem 2. typu: multicentrická, dvojitě zaslepená, randomizovaná placebem kontrolovaná studie nového probiotického přípravku Perreaudeau et al, BMJ 2021
Úvod Stále více důkazů naznačuje, že některé přirozeně se vyskytující střevní bakterie jsou ve střevním traktu osob s diabetem 2. typu (DM 2. typu) nedostatečně zastoupeny a že jejich funkce, např. stabilita střevní bariéry a produkce butyrátu, jsou důležité pro homeostázu glukózy a inzulinu. Cílem této studie je ověřit hypotézu, že enterální expozice mikrobům s těmito navrhovanými funkcemi může bezpečně zlepšit klinické ukazatele regulace glykémie, a tím hrát roli v celkové léčbě diabetu skrze řízenou dietu.
Metodologie výzkumu Hodnotili jsme, zda by probiotikum složené z těchto anaerobních bakterií bylo přínosné z hlediska léčby diabetu skrze řízenou dietu. Toto hodnocení probíhalo (1) výrobou dvou nových probiotických přípravků obsahujících tři (WBF-010) nebo pět (WBF-011) odlišných kmenů v zařízení, které splňuje požadavky cGMP, (2) stanovením konzistentních koncentrací živých buněk, (3) potvrzením bezpečnosti při cílových koncentracích dávkovaných ve studiích na zvířatech i na lidech a (4) provedením 12týdenní paralelní, dvojitě zaslepené, placebem kontrolované studie, v níž bylo osobám s dříve diagnostikovaným DM 2. typu (n = 76) dvakrát denně náhodně podáváno placebo, nebo WBF-010 či WBF-011.
Zjištění Nebyly pozorovány žádné problémy s bezpečností ani snášenlivostí. Ve srovnání s placebo skupinou se u subjektů, kterým byl podáván přípravek WBF-011 (který obsahuje inulin, Akkermansia muciniphila, Clostridium beijerinckii, Clostridium butyricum, Bifidobacterium infantis a Anaerobutyricum hallii), významně zlepšil primární výsledek, celková plocha pod křivkou glykemie (AUC): − 36,1 mg/dl/180 min, p = 0,0500 a hodnoty se zlepšily také v sekundárních výsledcích: glykovaná hemoglobin (A1c): V případě glukózy v krvi (A1c): − 0,6, přírůstek glukózy-AUC: − 28,6 mg/dl/180 min.
Závěr Pokud je nám známo, jedná se o první randomizovanou kontrolovanou studii, která podává osobám s DM 2. typu čtyři z pěti kmenů bakterií. Tato studie pro ověření koncepce s číslem NCT03893422 ukazuje, že intervence proběhla bezpečně, byla dobře tolerovaná a že suplementace přípravkem WBF-011 zlepšuje postprandiální regulaci glukózy. Omezená velikost vzorku a variabilita mezi jednotlivými subjekty opravňuje k provedení budoucích studií, jejichž cílem je tato pozorování potvrdit a rozšířit.
Zvýšení cirkulujícího butyrátu a ursodeoxycholátu během probiotické intervence u lidí s diabetem 2. typu Mc Murdie et al, BMC 2022 (https://bmcmicrobiol.biomedcentral.com/articles/10.1186/s12866-021-02415-8)
Souvislosti
Stále více důkazů naznačuje, že rezidentní střevní mikrobiota hraje rozhodující roli v patogenezi diabetu 2. typu (MD 2. typu). Ve dvojitě zaslepené, randomizované, placebem kontrolované studii (NCT03893422) jsem již dříve informovali o významném zlepšení postprandiální kontroly glukózy u lidských subjektů s MD 2. typu po 12týdenním podávání nového probiotického přípravku s 5 kmeny („WBF-011“). Ačkoli klinické konečné ukazatele byly povzbudivé, bylo zapotřebí provést další průzkumná měření, aby bylo možné spojit hypotézu spočívající na slibně fungujícím mechanismu týkajícím se zvýšeného množství mastných kyselin s krátkým řetězcem, s jednotlivými markery onemocnění.
Zjištění
Zde uvádíme výsledky cílených a necílených metabolomických měření provedených na plazmě nalačno (n = 104) odebrané na začátku a na konci intervence. U účastníků náhodně vybraných k léčbě přípravkem WBF-011 došlo ke zvýšení hladiny butyrátu a ursodeoxycholátu. Bylo také možné pozorovat velmi přesvědčivé trendy mezi butyrátem a glykovaným hemoglobinem (HbA1c). In vitro experimenty s monokulturou prokázaly, že kmen C. butyricum obsažený v přípravku během butyrogenního růstu účinně syntetizuje ursodeoxycholát z primární žlučové kyseliny chenodeoxycholátu. Necílená metabolomika rovněž odhalila koordinované snížení meziproduktů oxidace mastných kyselin a bilirubinu, což jsou potenciální sekundární znaky metabolického zlepšení. A konečně, zlepšení HbA1c bylo omezeno téměř výhradně na účastníky neužívající léky obsahující sulfonylurey. Podařilo se nám prokázat, že tyto léky mohou in vitro inhibovat růst formulačních kmenů.
Závěr
Pokud je nám známo, jedná se o první popis zvýšení cirkulujícího butyrátu nebo ursodeoxycholátu po probiotické intervenci u osob s MD 2. typu, což přispívá k podpoře možnosti cíleného přístupu založeného na mikrobiomech, který může být nápomocný při léčbě MD 2. typu. Zjištění týkající se účinné syntézy UDCA pomocí C. butyricum mohou být nápomocná v případě dalších výzkumů zabývajících se jeho využitím jako probiotika v dalších oblastech onemocnění. Při navrhování návazných studií je třeba pečlivě zvážit možnost inhibiční interakce mezi léčivy obsahujícími sulfonylurey a střevní mikroflórou.
Bibliografie
- Tailford, L. E., Crost, E. H., Kavanaugh, D. & Juge, N. Mucin glycan foraging in the human gut microbiome. Front. Genet. 6, 81 (2015).
- Velcich, A. et al. Colorectal cancer in mice genetically deficient in the mucin Muc2. Science 295, 1726–1729 (2002).
- Corfield, A. P. The Interaction of the Gut Microbiota with the Mucus Barrier in Health and Disease in Human. Microorganisms 6, (2018).
- Donaldson, G. P., Lee, S. M. & Mazmanian, S. K. Gut biogeography of the bacterial microbiota. Nat. Rev. Microbiol. 14, 20–32 (2016).
- Carey, H. V., Walters, W. A. & Knight, R. Seasonal restructuring of the ground squirrel gut microbiota over the annual hibernation cycle. Am. J. Physiol. Regul. Integr. Comp. Physiol. 304, R33-42 (2013).
- Sonoyama, K. et al. Response of gut microbiota to fasting and hibernation in Syrian hamsters. Appl. Environ. Microbiol. 75, 6451–6456 (2009).
- Derrien, M., Vaughan, E. E., Plugge, C. M. & de Vos, W. M. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int. J. Syst. Evol. Microbiol. 54, 1469–1476 (2004).
- Cani, P. D. & de Vos, W. M. Next-Generation Beneficial Microbes: The Case of Akkermansia muciniphila. Front. Microbiol. 8, 1765 (2017).
- de Vos, W. M. Microbe Profile: Akkermansia muciniphila: a conserved intestinal symbiont that acts as the gatekeeper of our mucosa. Microbiology (Reading, Engl) 163, 646–648 (2017).
- Reunanen, J. et al. Akkermansia muciniphila Adheres to Enterocytes and Strengthens the Integrity of the Epithelial Cell Layer. Appl. Environ. Microbiol. 81, 3655–3662 (2015).
- Belzer, C. et al. Microbial Metabolic Networks at the Mucus Layer Lead to Diet-Independent Butyrate and Vitamin B12 Production by Intestinal Symbionts. MBio 8, (2017).
- Lopez-Siles, M. et al. Cultured representatives of two major phylogroups of human colonic Faecalibacterium prausnitzii can utilize pectin, uronic acids, and host-derived substrates for growth. Appl. Environ. Microbiol. 78, 420–428 (2012).
- Chia, L. W. et al. Deciphering the trophic interaction between Akkermansia muciniphila and the butyrogenic gut commensal Anaerostipes caccae using a metatranscriptomic approach. Antonie Van Leeuwenhoek 111, 859–873 (2018).
- O’Neill, L. A. J., Golenbock, D. & Bowie, A. G. The history of Toll-like receptors – redefining innate immunity. Nat. Rev. Immunol. 13, 453–460 (2013).
- Pott, J. & Hornef, M. Innate immune signalling at the intestinal epithelium in homeostasis and disease. EMBO Rep. 13, 684–698 (2012).
- Meyer-Hoffert, U. et al. Secreted enteric antimicrobial activity localises to the mucus surface layer. Gut 57, 764–771 (2008).
- Wilmore, J. R. et al. Commensal Microbes Induce Serum IgA Responses that Protect against Polymicrobial Sepsis. Cell Host Microbe 23, 302-311.e3 (2018).
- Ivanov, I. I. & Honda, K. Intestinal commensal microbes as immune modulators. Cell Host Microbe 12, 496–508 (2012).
- Rollenske, T. & Macpherson, A. J. Anti-commensal Ig-from enormous diversity to clear function. Mucosal Immunol. 13, 1–2 (2020).
- Belkaid, Y. & Harrison, O. J. Homeostatic immunity and the microbiota. Immunity 46, 562–576 (2017).
- Cani, P. D. et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes 57, 1470–1481 (2008).
- Everard, A. et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc Natl Acad Sci USA 110, 9066–9071 (2013).
- Anhê, F. F. et al. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. population in the gut microbiota of mice. Gut 64, 872–883 (2015).
- Shin, N.-R. et al. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice. Gut 63, 727–735 (2014).
- Ottman, N. et al. Pili-like proteins of Akkermansia muciniphila modulate host immune responses and gut barrier function. PLoS ONE 12, e0173004 (2017).
- Plovier, H. et al. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nat. Med. 23, 107–113 (2017).
- Chelakkot, C. et al. Akkermansia muciniphila-derived extracellular vesicles influence gut permeability through the regulation of tight junctions. Exp. Mol. Med. 50, e450 (2018).
- Li, J., Lin, S., Vanhoutte, P. M., Woo, C. W. & Xu, A. Akkermansia Muciniphila Protects Against Atherosclerosis by Preventing Metabolic Endotoxemia-Induced Inflammation in Apoe-/- Mice. Circulation 133, 2434–2446 (2016).
- Grander, C. et al. Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic liver disease. Gut 67, 891–901 (2018).
- Wu, W. et al. Protective Effect of Akkermansia muciniphila against Immune-Mediated Liver Injury in a Mouse Model. Front. Microbiol. 8, 1804 (2017).
- van der Lugt, B. et al. Akkermansia muciniphila ameliorates the age-related decline in colonic mucus thickness and attenuates immune activation in accelerated aging Ercc1-/Δ7 mice. Immun. Ageing 16, 6 (2019).
- Kulkarni, D. H. et al. Goblet cell associated antigen passages support the induction and maintenance of oral tolerance. Mucosal Immunol. 13, 271–282 (2020).
- Ansaldo, E. et al. Akkermansia muciniphila induces intestinal adaptive immune responses during homeostasis. Science 364, 1179–1184 (2019).
- Belkaid, Y., Bouladoux, N. & Hand, T. W. Effector and memory T cell responses to commensal bacteria. Trends Immunol. 34, 299–306 (2013).
- Yang, Y. et al. Focused specificity of intestinal TH17 cells towards commensal bacterial antigens. Nature 510, 152–156 (2014).
- Lawenius, L. et al. Pasteurized Akkermansia muciniphila protects from fat mass gain but not from bone loss. Am. J. Physiol. Endocrinol. Metab. 318, E480–E491 (2020).
- Org, E. et al. Genetic and environmental control of host-gut microbiota interactions. Genome Res. 25, 1558–1569 (2015).
- Chevalier, C. et al. Gut Microbiota Orchestrates Energy Homeostasis during Cold. Cell 163, 1360–1374 (2015).
- Czech, M. P. Insulin action and resistance in obesity and type 2 diabetes. Nat. Med. 23, 804–814 (2017).
- Schneeberger, M. et al. Akkermansia muciniphila inversely correlates with the onset of inflammation, altered adipose tissue metabolism and metabolic disorders during obesity in mice. Sci. Rep. 5, 16643 (2015).
- Kim, S. et al. Akkermansia muciniphila Prevents Fatty Liver Disease, Decreases Serum Triglycerides, and Maintains Gut Homeostasis. Appl. Environ. Microbiol. 86, (2020).
- Wu, F. et al. An Akkermansia muciniphila subtype alleviates high-fat diet-induced metabolic disorders and inhibits the neurodegenerative process in mice. Anaerobe 61, 102138 (2019).
- Zhai, R. et al. Strain-Specific Anti-inflammatory Properties of Two Akkermansia muciniphila Strains on Chronic Colitis in Mice. Front. Cell. Infect. Microbiol. 9, 239 (2019).
- Lukovac, S. et al. Differential modulation by Akkermansia muciniphila and Faecalibacterium prausnitzii of host peripheral lipid metabolism and histone acetylation in mouse gut organoids. MBio 5, (2014).
- Zhao, S. et al. Akkermansia muciniphila improves metabolic profiles by reducing inflammation in chow diet-fed mice. J. Mol. Endocrinol. 58, 1–14 (2017).
- Everard, A. et al. Responses of gut microbiota and glucose and lipid metabolism to prebiotics in genetic obese and diet-induced leptin-resistant mice. Diabetes 60, 2775–2786 (2011).
- Kimura, I., Ichimura, A., Ohue-Kitano, R. & Igarashi, M. Free fatty acid receptors in health and disease. Physiol. Rev. 100, 171–210 (2020).
- De Vadder, F. et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits. Cell 156, 84–96 (2014).
- Cani, P. D. et al. Endocannabinoids–at the crossroads between the gut microbiota and host metabolism. Nat. Rev. Endocrinol. 12, 133–143 (2016).
- Alhouayek, M., Lambert, D. M., Delzenne, N. M., Cani, P. D. & Muccioli, G. G. Increasing endogenous 2-arachidonoylglycerol levels counteracts colitis and related systemic inflammation. FASEB J. 25, 2711–2721 (2011).
- Hansen, K. B. et al. 2-Oleoyl glycerol is a GPR119 agonist and signals GLP-1 release in humans. J. Clin. Endocrinol. Metab. 96, E1409-17 (2011).
Yoon, H.S., et al. (2021). Akkermansia muciniphila secretes a glucagon- like peptide-1-inducing protein that improves glucose homeostasis and ameliorates meta- bolic disease in mice. Nat. Microbiol. 6, 563–573.
- Zhang, H. et al. Human gut microbiota in obesity and after gastric bypass. Proc Natl Acad Sci USA 106, 2365–2370 (2009).
- Santacruz, A. et al. Gut microbiota composition is associated with body weight, weight gain and biochemical parameters in pregnant women. Br. J. Nutr. 104, 83–92 (2010).
- Karlsson, C. L. J. et al. The microbiota of the gut in preschool children with normal and excessive body weight. Obesity (Silver Spring) 20, 2257–2261 (2012).
- Clarke, S. F. et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut 63, 1913–1920 (2014).
- Kim, B.-S., Song, M.-Y. & Kim, H. The anti-obesity effect of Ephedra sinica through modulation of gut microbiota in obese Korean women. J. Ethnopharmacol. 152, 532–539 (2014).
- Dao, M. C. et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut 65, 426–436 (2016).
- Zhang, X. et al. Human gut microbiota changes reveal the progression of glucose intolerance. PLoS ONE 8, e71108 (2013).
- Depommier, C. et al. Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study. Nat. Med. 25, 1096–1103 (2019).
- Alard, J. et al. Beneficial metabolic effects of selected probiotics on diet-induced obesity and insulin resistance in mice are associated with improvement of dysbiotic gut microbiota. Environ. Microbiol. 18, 1484–1497 (2016).
- Pedret, A. et al. Effects of daily consumption of the probiotic Bifidobacterium animalis subsp. lactis CECT 8145 on anthropometric adiposity biomarkers in abdominally obese subjects: a randomized controlled trial. Int J Obes (Lond) 43, 1863–1868 (2019).
- Yang, Q. et al. Role of dietary nutrients in the modulation of gut microbiota: A narrative review. Nutrients 12, (2020).
- Ojo, B. et al. Mango Supplementation Modulates Gut Microbial Dysbiosis and Short-Chain Fatty Acid Production Independent of Body Weight Reduction in C57BL/6 Mice Fed a High-Fat Diet. J. Nutr. 146, 1483–1491 (2016).
- Remely, M. et al. Increased gut microbiota diversity and abundance of Faecalibacterium prausnitzii and Akkermansia after fasting: a pilot study. Wien. Klin. Wochenschr. 127, 394–398 (2015).
- Medina-Vera, I. et al. A dietary intervention with functional foods reduces metabolic endotoxaemia and attenuates biochemical abnormalities by modifying faecal microbiota in people with type 2 diabetes. Diabetes Metab. 45, 122–131 (2019).
- Candela, M. et al. Modulation of gut microbiota dysbioses in type 2 diabetic patients by macrobiotic Ma-Pi 2 diet. Br. J. Nutr. 116, 80–93 (2016).
- Holscher, H. D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes 8, 172–184 (2017).
- Reid, D. T., Eller, L. K., Nettleton, J. E. & Reimer, R. A. Postnatal prebiotic fibre intake mitigates some detrimental metabolic outcomes of early overnutrition in rats. Eur. J. Nutr. 55, 2399–2409 (2016).
- Hooda, S. et al. 454 pyrosequencing reveals a shift in fecal microbiota of healthy adult men consuming polydextrose or soluble corn fiber. J. Nutr. 142, 1259–1265 (2012).
- Roshanravan, N. et al. The effects of sodium butyrate and inulin supplementation on angiotensin signaling pathway via promotion of Akkermansia muciniphila abundance in type 2 diabetes; A randomized, double-blind, placebo-controlled trial. J. Cardiovasc. Thorac. Res. 9, 183–190 (2017).
- Halmos, E. P. et al. Consistent Prebiotic Effect on Gut Microbiota With Altered FODMAP Intake in Patients with Crohn’s Disease: A Randomised, Controlled Cross-Over Trial of Well-Defined Diets. Clin. Transl. Gastroenterol. 7, e164 (2016).
- Halmos, E. P. et al. Diets that differ in their FODMAP content alter the colonic luminal microenvironment. Gut 64, 93–100 (2015).
- Scalbert, A. & Williamson, G. Dietary intake and bioavailability of polyphenols. J. Nutr. 130, 2073S–85S (2000).
- Fuke, N., Nagata, N., Suganuma, H. & Ota, T. Regulation of Gut Microbiota and Metabolic Endotoxemia with Dietary Factors. Nutrients 11, (2019).
- Anhê, F. F. et al. Treatment with camu camu (Myrciaria dubia) prevents obesity by altering the gut microbiota and increasing energy expenditure in diet-induced obese mice. Gut (2018). doi:10.1136/gutjnl-2017-315565
- Roopchand, D. E. et al. Dietary Polyphenols Promote Growth of the Gut Bacterium Akkermansia muciniphila and Attenuate High-Fat Diet-Induced Metabolic Syndrome. Diabetes 64, 2847–2858 (2015).
- Ushiroda, C. et al. Green tea polyphenol (epigallocatechin-3-gallate) improves gut dysbiosis and serum bile acids dysregulation in high-fat diet-fed mice. J. Clin. Biochem. Nutr. 65, 34–46 (2019).
- Gurley, B. J. et al. Decaffeinated green tea extract does not elicit hepatotoxic effects and modulates the gut microbiome in lean B6C3F₁ mice. Nutrients 11, (2019).
- Baldwin, J. et al. Table grape consumption reduces adiposity and markers of hepatic lipogenesis and alters gut microbiota in butter fat-fed mice. J. Nutr. Biochem. 27, 123–135 (2015).
- García-Villalba, R. et al. Gastrointestinal Simulation Model TWIN-SHIME Shows Differences between Human Urolithin-Metabotypes in Gut Microbiota Composition, Pomegranate Polyphenol Metabolism, and Transport along the Intestinal Tract. J. Agric. Food Chem. 65, 5480–5493 (2017).
- Ouyang, J. et al. Metformin effect on gut microbiota: insights for HIV-related inflammation. AIDS Res. Ther. 17, 10 (2020).
- Lee, H. & Ko, G. Effect of metformin on metabolic improvement and gut microbiota. Appl. Environ. Microbiol. 80, 5935–5943 (2014).
- Zhou, Z.-Y. et al. Metformin exerts glucose-lowering action in high-fat fed mice via attenuating endotoxemia and enhancing insulin signaling. Acta Pharmacol. Sin. 37, 1063–1075 (2016).
- Wu, H. et al. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug. Nat. Med. 23, 850–858 (2017).
- König, J. et al. Human intestinal barrier function in health and disease. Clin. Transl. Gastroenterol. 7, e196 (2016).
- Zhai, Q., Feng, S., Arjan, N. & Chen, W. A next generation probiotic, Akkermansia muciniphila. Crit. Rev. Food Sci. Nutr. 59, 3227–3236 (2019).
- Xu, Y. et al. Function of Akkermansia muciniphila in Obesity: Interactions With Lipid Metabolism, Immune Response and Gut Systems. Front. Microbiol. 11, 219 (2020).
d 33, 194–201 (2017).
Doporučená vědecká literatura
Obecný popis střeva:
Článek poskytuje kvalitní přehled o stavbě střeva. Obsahuje informace o tom, kde se nacházejí jednotliví mikrobi a jaký vliv má jejich poloha na jejich funkci. Dále obsahuje také přehled mikrobů spojených s mucinem a informace o významu mucinu.
Donaldson, G. P., Lee, S. M. & Mazmanian, S. K. Gut biogeography of the bacterial microbiota. Nat. Rev. Microbiol. 14, 20–32 (2016).
Izolace Akkermansia muciniphila
První pokus o izolaci A. muciniphila z lidské stolice a následnou charakterizaci.
Derrien, M., Vaughan, E. E., Plugge, C. M. & de Vos, W. M. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int. J. Syst. Evol. Microbiol. 54, 1469–1476 (2004).
Komplexní přehledy o Akkermansia municiphila
Přehled A. muciniphila; první uvedený přehled je vytvořen hlavním výzkumným týmem, který se A. muciniphila zabývá, třetí přehled je nejnovější s důrazem na obezitu.
Cani, P. D. & de Vos, W. M. Next-Generation Beneficial Microbes: The Case of Akkermansia muciniphila. Front. Microbiol. 8, 1765 (2017).
Zhai, Q., Feng, S., Arjan, N. & Chen, W. A next generation probiotic, Akkermansia muciniphila. Crit. Rev. Food Sci. Nutr. 59, 3227–3236 (2019).
Xu, Y. et al. Function of Akkermansia muciniphila in Obesity: Interactions With Lipid Metabolism, Immune Response and Gut Systems. Front. Microbiol. 11, 219 (2020).
Primární literatura
Jeden z prvních a nejvíce citovaných článků o suplementaci A. muciniphila s pozitivními účinky u obézních myší.
Everard, A. et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc Natl Acad Sci USA 110, 9066–9071 (2013).
Základní informace o střevní bariéře a imunitě
Tento článek obsahuje základní informace o tom, jakým způsobem střevní bariéra reaguje na různá onemocnění.
König, J. et al. Human intestinal barrier function in health and disease. Clin. Transl. Gastroenterol. 7, e196 (2016).
Prebiotika a A. muciniphila
Přehled o způsobech, jak zvýšit množství A. muciniphila ve střevě.
Zhou, K. Strategies to promote abundance of Akkermansia muciniphila, an emerging probiotics in the gut, evidence from dietary intervention studies. J Funct Foo
Bibliografie
- Tailford, L. E., Crost, E. H., Kavanaugh, D. & Juge, N. Mucin glycan foraging in the human gut microbiome. Front. Genet. 6, 81 (2015).
- Velcich, A. et al. Colorectal cancer in mice genetically deficient in the mucin Muc2. Science 295, 1726–1729 (2002).
- Corfield, A. P. The Interaction of the Gut Microbiota with the Mucus Barrier in Health and Disease in Human. Microorganisms 6, (2018).
- Donaldson, G. P., Lee, S. M. & Mazmanian, S. K. Gut biogeography of the bacterial microbiota. Nat. Rev. Microbiol. 14, 20–32 (2016).
- Carey, H. V., Walters, W. A. & Knight, R. Seasonal restructuring of the ground squirrel gut microbiota over the annual hibernation cycle. Am. J. Physiol. Regul. Integr. Comp. Physiol. 304, R33-42 (2013).
- Sonoyama, K. et al. Response of gut microbiota to fasting and hibernation in Syrian hamsters. Appl. Environ. Microbiol. 75, 6451–6456 (2009).
- Derrien, M., Vaughan, E. E., Plugge, C. M. & de Vos, W. M. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int. J. Syst. Evol. Microbiol. 54, 1469–1476 (2004).
- Cani, P. D. & de Vos, W. M. Next-Generation Beneficial Microbes: The Case of Akkermansia muciniphila. Front. Microbiol. 8, 1765 (2017).
- de Vos, W. M. Microbe Profile: Akkermansia muciniphila: a conserved intestinal symbiont that acts as the gatekeeper of our mucosa. Microbiology (Reading, Engl) 163, 646–648 (2017).
- Reunanen, J. et al. Akkermansia muciniphila Adheres to Enterocytes and Strengthens the Integrity of the Epithelial Cell Layer. Appl. Environ. Microbiol. 81, 3655–3662 (2015).
- Belzer, C. et al. Microbial Metabolic Networks at the Mucus Layer Lead to Diet-Independent Butyrate and Vitamin B12 Production by Intestinal Symbionts. MBio 8, (2017).
- Lopez-Siles, M. et al. Cultured representatives of two major phylogroups of human colonic Faecalibacterium prausnitzii can utilize pectin, uronic acids, and host-derived substrates for growth. Appl. Environ. Microbiol. 78, 420–428 (2012).
- Chia, L. W. et al. Deciphering the trophic interaction between Akkermansia muciniphila and the butyrogenic gut commensal Anaerostipes caccae using a metatranscriptomic approach. Antonie Van Leeuwenhoek 111, 859–873 (2018).
- O’Neill, L. A. J., Golenbock, D. & Bowie, A. G. The history of Toll-like receptors – redefining innate immunity. Nat. Rev. Immunol. 13, 453–460 (2013).
- Pott, J. & Hornef, M. Innate immune signalling at the intestinal epithelium in homeostasis and disease. EMBO Rep. 13, 684–698 (2012).
- Meyer-Hoffert, U. et al. Secreted enteric antimicrobial activity localises to the mucus surface layer. Gut 57, 764–771 (2008).
- Wilmore, J. R. et al. Commensal Microbes Induce Serum IgA Responses that Protect against Polymicrobial Sepsis. Cell Host Microbe 23, 302-311.e3 (2018).
- Ivanov, I. I. & Honda, K. Intestinal commensal microbes as immune modulators. Cell Host Microbe 12, 496–508 (2012).
- Rollenske, T. & Macpherson, A. J. Anti-commensal Ig-from enormous diversity to clear function. Mucosal Immunol. 13, 1–2 (2020).
- Belkaid, Y. & Harrison, O. J. Homeostatic immunity and the microbiota. Immunity 46, 562–576 (2017).
- Cani, P. D. et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes 57, 1470–1481 (2008).
- Everard, A. et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc Natl Acad Sci USA 110, 9066–9071 (2013).
- Anhê, F. F. et al. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. population in the gut microbiota of mice. Gut 64, 872–883 (2015).
- Shin, N.-R. et al. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice. Gut 63, 727–735 (2014).
- Ottman, N. et al. Pili-like proteins of Akkermansia muciniphila modulate host immune responses and gut barrier function. PLoS ONE 12, e0173004 (2017).
- Plovier, H. et al. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nat. Med. 23, 107–113 (2017).
- Chelakkot, C. et al. Akkermansia muciniphila-derived extracellular vesicles influence gut permeability through the regulation of tight junctions. Exp. Mol. Med. 50, e450 (2018).
- Li, J., Lin, S., Vanhoutte, P. M., Woo, C. W. & Xu, A. Akkermansia Muciniphila Protects Against Atherosclerosis by Preventing Metabolic Endotoxemia-Induced Inflammation in Apoe-/- Mice. Circulation 133, 2434–2446 (2016).
- Grander, C. et al. Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic liver disease. Gut 67, 891–901 (2018).
- Wu, W. et al. Protective Effect of Akkermansia muciniphila against Immune-Mediated Liver Injury in a Mouse Model. Front. Microbiol. 8, 1804 (2017).
- van der Lugt, B. et al. Akkermansia muciniphila ameliorates the age-related decline in colonic mucus thickness and attenuates immune activation in accelerated aging Ercc1-/Δ7 mice. Immun. Ageing 16, 6 (2019).
- Kulkarni, D. H. et al. Goblet cell associated antigen passages support the induction and maintenance of oral tolerance. Mucosal Immunol. 13, 271–282 (2020).
- Ansaldo, E. et al. Akkermansia muciniphila induces intestinal adaptive immune responses during homeostasis. Science 364, 1179–1184 (2019).
- Belkaid, Y., Bouladoux, N. & Hand, T. W. Effector and memory T cell responses to commensal bacteria. Trends Immunol. 34, 299–306 (2013).
- Yang, Y. et al. Focused specificity of intestinal TH17 cells towards commensal bacterial antigens. Nature 510, 152–156 (2014).
- Lawenius, L. et al. Pasteurized Akkermansia muciniphila protects from fat mass gain but not from bone loss. Am. J. Physiol. Endocrinol. Metab. 318, E480–E491 (2020).
- Org, E. et al. Genetic and environmental control of host-gut microbiota interactions. Genome Res. 25, 1558–1569 (2015).
- Chevalier, C. et al. Gut Microbiota Orchestrates Energy Homeostasis during Cold. Cell 163, 1360–1374 (2015).
- Czech, M. P. Insulin action and resistance in obesity and type 2 diabetes. Nat. Med. 23, 804–814 (2017).
- Schneeberger, M. et al. Akkermansia muciniphila inversely correlates with the onset of inflammation, altered adipose tissue metabolism and metabolic disorders during obesity in mice. Sci. Rep. 5, 16643 (2015).
- Kim, S. et al. Akkermansia muciniphila Prevents Fatty Liver Disease, Decreases Serum Triglycerides, and Maintains Gut Homeostasis. Appl. Environ. Microbiol. 86, (2020).
- Wu, F. et al. An Akkermansia muciniphila subtype alleviates high-fat diet-induced metabolic disorders and inhibits the neurodegenerative process in mice. Anaerobe 61, 102138 (2019).
- Zhai, R. et al. Strain-Specific Anti-inflammatory Properties of Two Akkermansia muciniphila Strains on Chronic Colitis in Mice. Front. Cell. Infect. Microbiol. 9, 239 (2019).
- Lukovac, S. et al. Differential modulation by Akkermansia muciniphila and Faecalibacterium prausnitzii of host peripheral lipid metabolism and histone acetylation in mouse gut organoids. MBio 5, (2014).
- Zhao, S. et al. Akkermansia muciniphila improves metabolic profiles by reducing inflammation in chow diet-fed mice. J. Mol. Endocrinol. 58, 1–14 (2017).
- Everard, A. et al. Responses of gut microbiota and glucose and lipid metabolism to prebiotics in genetic obese and diet-induced leptin-resistant mice. Diabetes 60, 2775–2786 (2011).
- Kimura, I., Ichimura, A., Ohue-Kitano, R. & Igarashi, M. Free fatty acid receptors in health and disease. Physiol. Rev. 100, 171–210 (2020).
- De Vadder, F. et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits. Cell 156, 84–96 (2014).
- Cani, P. D. et al. Endocannabinoids–at the crossroads between the gut microbiota and host metabolism. Nat. Rev. Endocrinol. 12, 133–143 (2016).
- Alhouayek, M., Lambert, D. M., Delzenne, N. M., Cani, P. D. & Muccioli, G. G. Increasing endogenous 2-arachidonoylglycerol levels counteracts colitis and related systemic inflammation. FASEB J. 25, 2711–2721 (2011).
- Hansen, K. B. et al. 2-Oleoyl glycerol is a GPR119 agonist and signals GLP-1 release in humans. J. Clin. Endocrinol. Metab. 96, E1409-17 (2011).
Yoon, H.S., et al. (2021). Akkermansia muciniphila secretes a glucagon- like peptide-1-inducing protein that improves glucose homeostasis and ameliorates meta- bolic disease in mice. Nat. Microbiol. 6, 563–573.
- Zhang, H. et al. Human gut microbiota in obesity and after gastric bypass. Proc Natl Acad Sci USA 106, 2365–2370 (2009).
- Santacruz, A. et al. Gut microbiota composition is associated with body weight, weight gain and biochemical parameters in pregnant women. Br. J. Nutr. 104, 83–92 (2010).
- Karlsson, C. L. J. et al. The microbiota of the gut in preschool children with normal and excessive body weight. Obesity (Silver Spring) 20, 2257–2261 (2012).
- Clarke, S. F. et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut 63, 1913–1920 (2014).
- Kim, B.-S., Song, M.-Y. & Kim, H. The anti-obesity effect of Ephedra sinica through modulation of gut microbiota in obese Korean women. J. Ethnopharmacol. 152, 532–539 (2014).
- Dao, M. C. et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut 65, 426–436 (2016).
- Zhang, X. et al. Human gut microbiota changes reveal the progression of glucose intolerance. PLoS ONE 8, e71108 (2013).
- Depommier, C. et al. Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study. Nat. Med. 25, 1096–1103 (2019).
- Alard, J. et al. Beneficial metabolic effects of selected probiotics on diet-induced obesity and insulin resistance in mice are associated with improvement of dysbiotic gut microbiota. Environ. Microbiol. 18, 1484–1497 (2016).
- Pedret, A. et al. Effects of daily consumption of the probiotic Bifidobacterium animalis subsp. lactis CECT 8145 on anthropometric adiposity biomarkers in abdominally obese subjects: a randomized controlled trial. Int J Obes (Lond) 43, 1863–1868 (2019).
- Yang, Q. et al. Role of dietary nutrients in the modulation of gut microbiota: A narrative review. Nutrients 12, (2020).
- Ojo, B. et al. Mango Supplementation Modulates Gut Microbial Dysbiosis and Short-Chain Fatty Acid Production Independent of Body Weight Reduction in C57BL/6 Mice Fed a High-Fat Diet. J. Nutr. 146, 1483–1491 (2016).
- Remely, M. et al. Increased gut microbiota diversity and abundance of Faecalibacterium prausnitzii and Akkermansia after fasting: a pilot study. Wien. Klin. Wochenschr. 127, 394–398 (2015).
- Medina-Vera, I. et al. A dietary intervention with functional foods reduces metabolic endotoxaemia and attenuates biochemical abnormalities by modifying faecal microbiota in people with type 2 diabetes. Diabetes Metab. 45, 122–131 (2019).
- Candela, M. et al. Modulation of gut microbiota dysbioses in type 2 diabetic patients by macrobiotic Ma-Pi 2 diet. Br. J. Nutr. 116, 80–93 (2016).
- Holscher, H. D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes 8, 172–184 (2017).
- Reid, D. T., Eller, L. K., Nettleton, J. E. & Reimer, R. A. Postnatal prebiotic fibre intake mitigates some detrimental metabolic outcomes of early overnutrition in rats. Eur. J. Nutr. 55, 2399–2409 (2016).
- Hooda, S. et al. 454 pyrosequencing reveals a shift in fecal microbiota of healthy adult men consuming polydextrose or soluble corn fiber. J. Nutr. 142, 1259–1265 (2012).
- Roshanravan, N. et al. The effects of sodium butyrate and inulin supplementation on angiotensin signaling pathway via promotion of Akkermansia muciniphila abundance in type 2 diabetes; A randomized, double-blind, placebo-controlled trial. J. Cardiovasc. Thorac. Res. 9, 183–190 (2017).
- Halmos, E. P. et al. Consistent Prebiotic Effect on Gut Microbiota With Altered FODMAP Intake in Patients with Crohn’s Disease: A Randomised, Controlled Cross-Over Trial of Well-Defined Diets. Clin. Transl. Gastroenterol. 7, e164 (2016).
- Halmos, E. P. et al. Diets that differ in their FODMAP content alter the colonic luminal microenvironment. Gut 64, 93–100 (2015).
- Scalbert, A. & Williamson, G. Dietary intake and bioavailability of polyphenols. J. Nutr. 130, 2073S–85S (2000).
- Fuke, N., Nagata, N., Suganuma, H. & Ota, T. Regulation of Gut Microbiota and Metabolic Endotoxemia with Dietary Factors. Nutrients 11, (2019).
- Anhê, F. F. et al. Treatment with camu camu (Myrciaria dubia) prevents obesity by altering the gut microbiota and increasing energy expenditure in diet-induced obese mice. Gut (2018). doi:10.1136/gutjnl-2017-315565
- Roopchand, D. E. et al. Dietary Polyphenols Promote Growth of the Gut Bacterium Akkermansia muciniphila and Attenuate High-Fat Diet-Induced Metabolic Syndrome. Diabetes 64, 2847–2858 (2015).
- Ushiroda, C. et al. Green tea polyphenol (epigallocatechin-3-gallate) improves gut dysbiosis and serum bile acids dysregulation in high-fat diet-fed mice. J. Clin. Biochem. Nutr. 65, 34–46 (2019).
- Gurley, B. J. et al. Decaffeinated green tea extract does not elicit hepatotoxic effects and modulates the gut microbiome in lean B6C3F₁ mice. Nutrients 11, (2019).
- Baldwin, J. et al. Table grape consumption reduces adiposity and markers of hepatic lipogenesis and alters gut microbiota in butter fat-fed mice. J. Nutr. Biochem. 27, 123–135 (2015).
- García-Villalba, R. et al. Gastrointestinal Simulation Model TWIN-SHIME Shows Differences between Human Urolithin-Metabotypes in Gut Microbiota Composition, Pomegranate Polyphenol Metabolism, and Transport along the Intestinal Tract. J. Agric. Food Chem. 65, 5480–5493 (2017).
- Ouyang, J. et al. Metformin effect on gut microbiota: insights for HIV-related inflammation. AIDS Res. Ther. 17, 10 (2020).
- Lee, H. & Ko, G. Effect of metformin on metabolic improvement and gut microbiota. Appl. Environ. Microbiol. 80, 5935–5943 (2014).
- Zhou, Z.-Y. et al. Metformin exerts glucose-lowering action in high-fat fed mice via attenuating endotoxemia and enhancing insulin signaling. Acta Pharmacol. Sin. 37, 1063–1075 (2016).
- Wu, H. et al. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug. Nat. Med. 23, 850–858 (2017).
- König, J. et al. Human intestinal barrier function in health and disease. Clin. Transl. Gastroenterol. 7, e196 (2016).
- Zhai, Q., Feng, S., Arjan, N. & Chen, W. A next generation probiotic, Akkermansia muciniphila. Crit. Rev. Food Sci. Nutr. 59, 3227–3236 (2019).
- Xu, Y. et al. Function of Akkermansia muciniphila in Obesity: Interactions With Lipid Metabolism, Immune Response and Gut Systems. Front. Microbiol. 11, 219 (2020).
d 33, 194–201 (2017).

